题目内容
15.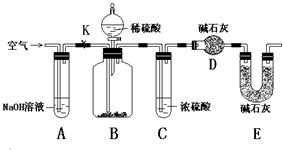 纯碱中常含有少量NaCl杂质.甲同学用下面的装置测定n g纯碱中Na2CO3的质量分数.其实验步骤:
纯碱中常含有少量NaCl杂质.甲同学用下面的装置测定n g纯碱中Na2CO3的质量分数.其实验步骤:a.按装置图组装仪器,并检查其气密性;
b.称量盛有碱石灰的干燥管D的质量为m1g;
c.称量n g纯碱样品,并将其放入广口瓶内;
d.从分液漏斗缓缓地注入一定量的稀硫酸,并缓缓地鼓入空气,直到B反应器中不再产生气体为止;
e.再次称量干燥管D的总质量为m2g.
请回答:
(1)装置C的作用是干燥CO2.装置E的作用是防止空气中水蒸气和CO2进入干燥器D.
(2)计算Na2CO3质量分数的数学表达式为(用m1、m2、n表示)$\frac{53({m}_{3}-{m}_{2})}{22n}$.
(3)请再设计两种其他的测定方案,并填写表中空白.
可选择的主要仪器:①托盘天平 ②烧杯 ③玻璃棒 ④铁架台、漏斗(过滤器) ⑤干燥管 ⑥酒精灯 ⑦烧瓶 ⑧蒸发皿
供选择的试剂:a.CaCl2溶液 b.稀硝酸 c.AgNO3溶液 d.碱石灰 e.稀盐酸
| 实验中所发生反应的 化学方程式 | 实验所用主要仪器 (用编号表示) | 实验需直接测定的有关物理量(用文字说明) |
分析 装置A中的氢氧化钠溶液吸收空气中的二氧化碳,利用除去二氧化碳的空气排净装置中的空气,关闭K后从分液漏斗缓缓地注入一定量的稀硫酸,和样品发生反应,并缓缓地鼓入空气,直到B反应器中不再产生气体为止,生成的气体中水蒸气通过浓硫酸吸收水蒸气,进入装置D吸收生成的二氧化碳,装置E是防止空气中二氧化碳进入装置D防止干扰影响测定结果,
(1)装置C中浓硫酸是吸收二氧化碳气体中的水蒸气,空气中二氧化碳、水蒸气进入D中影响二氧化碳的质量测定,导致测定二氧化碳的质量增大,E装置的作用是吸收空气中二氧化碳中和水蒸气,防止进入装置D中;
(2)称量盛有碱石灰的干燥管D的质量为m1g为吸收二氧化碳的质量,依据碳元素守恒计算碳酸钠质量得到碳酸钠的质量分数;
(3)纯碱中常含有少量NaCl杂质,测定n g纯碱中Na2CO3的质量分数,可以利用氯化钙和碳酸钠反应生成沉淀,称量沉淀质量计算得到,需要的仪器为①托盘天平 ②烧杯 ③玻璃棒 ④铁架台、漏斗(过滤器);利用硝酸和碳酸钠反应后的溶液中加入硝酸银和氯化钠反应生成氯化银沉淀,称量沉淀质量计算得到,需要的仪器为①托盘天平 ②烧杯 ③玻璃棒 ④铁架台、漏斗(过滤器);利用硝酸和碳酸钠完全反应后,溶液蒸干得到氯化钠晶体,称量质量计算,需要的仪器:①托盘天平 ②烧杯 ③玻璃棒 ④铁架台、漏斗(过滤器)、⑧蒸发皿;利用盐酸和碳酸钠溶液反应后得到溶液蒸干得到氯化钠晶体质量,依据元素守恒和质量计算得到,需要的仪器为:①②③⑥⑧;
解答 解:(1)装置C的作用是吸收二氧化碳气体中的水蒸气,空气中二氧化碳、水蒸气进入D中影响二氧化碳的质量测定,导致测定二氧化碳的质量增大,E装置的作用是吸收空气中二氧化碳中和水蒸气,防止进入装置D中,
故答案为:干燥CO2 防止空气中水蒸气和CO2进入干燥器D;
(2)称量盛有碱石灰的干燥管D的质量为m1g为吸收二氧化碳的质量,元素守恒得到碳酸钠质量分数=$\frac{\frac{{m}_{1}}{44}mol×106g/mol}{ng}$×100%=$\frac{53({m}_{3}-{m}_{2})}{22n}$×100%,
故答案为:$\frac{53({m}_{3}-{m}_{2})}{22n}$×100%;
(3)纯碱中常含有少量NaCl杂质,测定n g纯碱中Na2CO3的质量分数,可以利用氯化钙和碳酸钠反应生成沉淀,称量沉淀质量计算得到,需要的仪器为①托盘天平 ②烧杯 ③玻璃棒 ④铁架台、漏斗(过滤器);利用硝酸和碳酸钠反应后的溶液中加入硝酸银和氯化钠反应生成氯化银沉淀,称量沉淀质量计算得到,需要的仪器为①托盘天平 ②烧杯 ③玻璃棒 ④铁架台、漏斗(过滤器);利用硝酸和碳酸钠完全反应后,溶液蒸干得到氯化钠晶体,称量质量计算,需要的仪器:①托盘天平 ②烧杯 ③玻璃棒 ④铁架台、漏斗(过滤器)、⑧蒸发皿;利用盐酸和碳酸钠溶液反应后得到溶液蒸干得到氯化钠晶体质量,依据元素守恒和质量计算得到,需要的仪器为:①②③⑥⑧,
故答案为:
| 实验中所发生反应的 化学方程式 | 实验所用主要仪器(用编号表示) | 实验需直接测定的有关物理量(用文字说明) |
| CaCl2+Na2CO3=2NaCl+CaCO3↓ | ①②③④ | CaCO3沉淀的质量 |
| 2HNO3+Na2CO3=2NaNO3+CO2↑+H2O AgNO3+NaCl=NaNO3+AgCl↓ | ①②③④ | AgCl沉淀的质量 |
| 2HNO3+Na2CO3=2NaNO3+CO2↑+H2O | ①②③⑥⑧ | 蒸干后所得 固体的质量 |
| 2HCl+Na2CO3=2NaCl+CO2↑+H2O | ①②③⑥⑧ | 蒸干后所得 固体的质量 |
点评 本题考查学生对实验原理及装置理解、对操作的评价、物质含量的测定、化学计算等,难度中等,根据物质的化学性质,要认真分析,把握实验设计的每个步骤中的实验目的.

| A. | CO (g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol[ | |
| B. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| C. | 用等体积的0.50mol•L-1盐酸、0.55mol•L-1NaOH溶液进行中和热测定的实验,会使测得的值偏大 | |
| D. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
| A. | 用熟石灰可处理酸性废水 | B. | 焊锡(锡铅合金)熔点比金属锡高 | ||
| C. | 用丁达尔效应可区分溶液和胶体 | D. | 用热的纯碱溶液可清除油污 |
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2/mol•L-1 | 0.010 | 0.020 | 0.020 |
| c(I2)/mol•L-1 | 0.010 | 0.010 | 0.020 |
| A. | 平衡时甲中和丙中H2的转化率相同 | |
| B. | 平衡时乙中I2的转化率小于40% | |
| C. | 平衡时乙中c(HI)比甲中的2倍大 | |
| D. | 反应平衡时,丙中气体颜色最深,乙中气体颜色最浅 |
| A. | -44.2kJ/mol | B. | +44.2kJ/mol | C. | -330kJ/mol | D. | +330kJ/mol |




