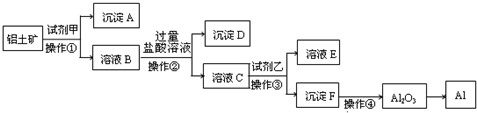
题目内容
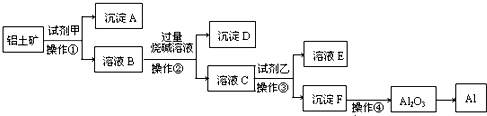
(1)工业上由Al2O3 冶炼金属Al所采用的方法是
a.电解法 b.加热分解 c.加入还原剂
(2)若在实验室中完成上述流程,操作①~④中属于过滤的是
(3)加入试剂甲后发生反应的离子方程式是
(4)在溶液B中加入过量烧碱溶液的目的是
(1)工业上利用电解熔融的Al2O3 冶炼金属Al,注意需要加入冰晶石,降低Al2O3 的熔点;
(2)由工业流程可知,操作①、②、③是分离固体与液体,应是过滤,操作④是对沉淀氢氧化铝加热灼烧生成氧化铝;
(3)由工艺流程可知操作②加入过量的氢氧化钠溶液,所以滤液C含有AlO2-,操作①应加入盐酸,试剂甲应为盐酸,溶解Fe2O3、Al2O3,二氧化硅不溶解,通过过滤操作除去;
(4)由工业流程可知,溶液B中含有铝离子、铁离子,加入过量的氢氧化钠溶液,使铁离子转化为氢氧化铁沉淀,除去铁离子,将铝离子转化为偏铝酸根.
故答案为:a;
(2)由工业流程可知,操作①、②、③是分离固体与液体,应是过滤,操作④是对沉淀氢氧化铝加热灼烧生成氧化铝,
故答案为:①、②、③;
(3)由工艺流程可知,操作②加入过量的氢氧化钠溶液,所以滤液C含有AlO2-,操作①应加入盐酸,试剂甲应为盐酸,溶解Fe2O3、Al2O3,二氧化硅不溶解,通过过滤操作除去,氧化铝与酸反应离子方程式为Al2O3+6H+=2Al3++3H2O,氧化铁与盐酸反应离子方程式为Fe2O3+6H+=2Fe3++3H2O,
故答案为:Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O;
(4)由工业流程可知,溶液B中含有铝离子、铁离子,加入过量的氢氧化钠溶液,使铁离子转化为氢氧化铁沉淀,除去铁离子,将铝离子转化为偏铝酸根,
故答案为:将铁离子转化为氢氧化铁沉淀,除去铁离子,将铝离子转化为偏铝酸根.

 目前流通的第五套人民币硬币材料分别为:1元硬币为铜芯镀镍合金,5角硬币为铜芯镀铜合金,1角硬币为硬铝合金.请回答:(题目中的百分含量均为质量分数)
目前流通的第五套人民币硬币材料分别为:1元硬币为铜芯镀镍合金,5角硬币为铜芯镀铜合金,1角硬币为硬铝合金.请回答:(题目中的百分含量均为质量分数)(1)钢是含碳量为0.03%~2%的
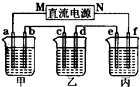
(2)如图所示的装置中,甲、乙、丙三个烧杯分别盛放足量的溶液,电极及溶液如下表所示:
| 电极 | a | b | c | d | e | f |
| 石墨 | 石墨 | 铜 | 钢 | 钢 | 铜 | |
| 溶液 | NaCl溶液 | CuSO4溶液 | CuSO4溶液 | |||
①上述装置中M极为直流电源的
②若在钢币上镀铜,应选择
(3)工业上以铝土矿(主要成分Al2O3?nH2O,含少量的氧化铁和石英等杂质)为原料生产铝.为除去铝土矿样品中氧化铁和石英杂质,要将粉碎、筛选后的铝土矿样品溶解在足量的氢氧化钠溶液中处理,请写出有关反应的离子方程式
(4)已知硬铝中含Cu:2.2%~5%、Mg:0.2%~3%、Mn:0.3%~1.5%、Si:0.5%,其余是Al.1角硬币单枚质量为2.20克,若想制得1角硬币1百万枚,理论上至少需要含Al2O3 90%的铝土矿约
目前流通的第五套人民币硬币材料分别为:1元硬币为铜芯镀镍合金,5角硬币为铜芯镀铜合金,1角硬币为硬铝合金。请回答:(题目中的百分含量均为质量分数)
(1)钢是含碳量为0.03%~2%的___________(填物质类别名称)。
(2)下图所示的装置中,甲、乙、丙三个烧杯分别盛放足量的溶液,电极及溶液如下表所示:
| 电极 | a | b | c | d | e | f |
| 石墨 | 石墨 | 铜 | 钢 | 钢 | 铜 | |
| 溶液 | NaCl溶液 | CuSO4溶液 | CuSO4溶液 |
通电后电极a上可产生能使湿润的碘化钾淀粉试纸变蓝的气体。
①上述装置中M极为直流电源的_________极(填“正”或“负”),电极b上发生的电极反应式为__________________________________________。
②若在钢币上镀铜,应选择_______烧杯(填“乙”或“丙”),当电极a上生成标准状况下气体2240 mL时,理论上可在电极_______(填字母)上镀铜_______g。
(3)工业上以铝土矿(主要成分Al2O3·nH2O,含少量的氧化铁和石英等杂质)为原料生产铝。为除去铝土矿样品中氧化铁和石英杂质,要将粉碎、筛选后的铝土矿样品溶解在足量的氢氧化钠溶液中处理,请写出有关反应的离子方程式__________________________。
(4)已知硬铝中含Cu:2.2%~5%、Mg:0.2%~3%、Mn:0.3%~1.5%、Si:0.5%,其余是Al。1角硬币单枚质量为2.20克,若想制得1角硬币1百万枚,理论上至少需要含Al2O3 90%的铝土矿约_______吨(小数点后保留一位数字)。
目前流通的第五套人民币硬币材料分别为:1元硬币为铜芯镀镍合金,5角硬币为铜芯镀铜合金,1角硬币为硬铝合金。请回答:(题目中的百分含量均为质量分数)
(1)钢是含碳量为0.03%~2%的___________(填物质类别名称)。
(2)下图所示的装置中,甲、乙、丙三个烧杯分别盛放足量的溶液,电极及溶液如下表所示:
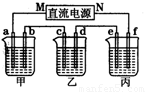
|
电极 |
a[来源:ZXXK] |
b |
c |
d |
e |
f[来源:学+科+网Z+X+X+K] |
|
石墨 |
石墨 |
铜 |
钢 |
钢 |
铜 |
|
|
溶液 |
NaCl溶液 |
CuSO4溶液 |
CuSO4溶液 |
通电后电极a上可产生能使湿润的碘化钾淀粉试纸变蓝的气体。
①上述装置中M极为直流电源的_________极(填“正”或“负”),电极b上发生的电极反应式为__________________________________________。
②若在钢币上镀铜,应选择_______烧杯(填“乙”或“丙”),当电极a上生成标准状况下气体2240 mL时,理论上可在电极_______(填字母)上镀铜_______g。
(3)工业上以铝土矿(主要成分Al2O3·nH2O,含少量的氧化铁和石英等杂质)为原料生产铝。为除去铝土矿样品中氧化铁和石英杂质,要将粉碎、筛选后的铝土矿样品溶解在足量的氢氧化钠溶液中处理,请写出有关反应的离子方程式__________________________。
(4)已知硬铝中含Cu:2.2%~5%、Mg:0.2%~3%、Mn:0.3%~1.5%、Si:0.5%,其余是Al。1角硬币单枚质量为2.20克,若想制得1角硬币1百万枚,理论上至少需要含Al2O3 90%的铝土矿约_______吨(小数点后保留一位数字)。