题目内容
(11分)A、B、C、D、E为元素周期表中前三周期元素形成的五种离子,A、B、C、D四种离子的电子数均比E的电子数少8.
(1)A与B结合成的化合物甲中既有离子键又有共价键,A与C结合成的化合物乙难溶于水,乙溶于甲的水溶液得无色透明溶液,C元素在周期表中的位置为________________乙与甲的水溶液反应的离子方程式为_______________________________________.
(2)B与E结合成化合物丙,其中离子数之比为2∶1,A与D结合成化合物丁,丁与丙反应产生无色无味的气体,该反应的化学方程式为 ______________________
(3)有一种液态氮氢化合物戊,分子中氮与氢两种元素的质量比为7∶1,与E的电子数相同,是“神舟七号”飞船发射时使用的高能燃料之一,结构分析发现该分子结构中只有单键,与氨相似,则戊的结构式为_____________,1 mol戊与过量盐酸反应的离子方程式是 ________________________ 戊在氧化还原反应中与H2O2相似,既可作氧化剂,又可作还原剂,根据价态分析产生这种情况的原因是_______________________________________________________________;8 g液态戊与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,放出375 kJ的热量,写出该反应的热化学方程式
________________________________________________________________
(1)第三周期第ⅢA族 Al(OH)3+OH-===AlO+2H2O
(2)2Na2O2+2H2O===4NaOH+O2↑
(3) 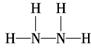 N2H4+2H+===N2H
N2H4+2H+===N2H 戊中氮元素的化合价为-2价,既可以升高,又可以降低
戊中氮元素的化合价为-2价,既可以升高,又可以降低
N2H4(l)+2H2O2(l)===N2(g)+4H2O(g)ΔH=-1 500 kJ/mo
【解析】

 科学实验活动册系列答案
科学实验活动册系列答案现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)B基态原子中能量最高的电子,其电子云在空间有
形.
(3)画出C原子的电子排布图
(4)已知BA5为离子化合物,写出其电子式
(5)DE3中心原子的杂化方式为
(6)用电子式表示F元素与E元素形成化合物的形成过程
 A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:
A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:

