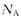题目内容
NA为阿伏加德罗常数,下列叙述正确的是( )
| A.反应5I—+IO3—+6H+ = 3I2 +3H2O生成3mol碘单质转移电子数为5NA |
| B.1 mol Na2O2溶于水作用时转移的电子数为2NA |
| C.在标准状况下,含NA个氦原子的氦气所含的分子数是0.5 NA |
| D.在7.8 g Na2O2晶体中阳离子与阴离子总数为0.4 NA |
A
A正确,反应5I—+IO3—+6H+ = 3I2 +3H2O 中I—的化合价由—1价升高到0价,IO3—中I元素的化合价由+5价降低到0价,所以生成3mol碘单质转移电子数为5NA;
B错,1 mol Na2O2溶于水作用时转移的电子数为NA;C错,氦为单原子分子,所以含NA个氦原子的氦气所含的分子数是 NA;D错,Na2O2晶体是阳离子与阴离子个数比为2:1,7.8 g Na2O2晶体的物质的量为0.1mol,所以7.8 g Na2O2晶体中阳离子与阴离子总数为0.3 NA
B错,1 mol Na2O2溶于水作用时转移的电子数为NA;C错,氦为单原子分子,所以含NA个氦原子的氦气所含的分子数是 NA;D错,Na2O2晶体是阳离子与阴离子个数比为2:1,7.8 g Na2O2晶体的物质的量为0.1mol,所以7.8 g Na2O2晶体中阳离子与阴离子总数为0.3 NA

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
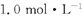 的氨水中
的氨水中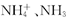 和
和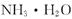 的总数为
的总数为