题目内容
图中a、b、c、d、e、f为元素周期表中前4周期的一部分元素,下列有关叙述正确的是
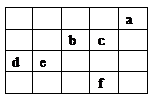
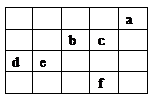
| A.b、c、e三种元素的原子半径大小关系:e>c>b |
| B.六种元素分别形成的单质固体中,d的熔、沸点最高 |
| C.c的氢化物沸点比f的氢化物沸点低 |
| D.b元素除0价外,只有一种化合价 |
B
试题分析:根据“a、b、c、d、e、f为元素周期表中前4周期的一部 素”可推知:A、同周期元素原子半径由左到右逐渐减小知原子半径O>F,即b>c,错误;B、d为硅元素其单质为原子晶体,其他为分子晶体,d的熔、沸点最高,正确;C、c的氢化物HF分子间存在氢键,沸点比f的氢化物HBr高,错误;D、b为氧元素除0价外,还有-1、-2等化合价,错误。
| | | | | a:He |
| | | b:O | c:F | |
| d:Si | e:P | | | |
| | | | f:Br | |

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
 1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2 。下列说法正确的是( )
1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2 。下列说法正确的是( )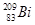 i和
i和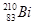 的说法正确的是
的说法正确的是 (核磁共振)可以用于含碳化合物的结构分析,有关
(核磁共振)可以用于含碳化合物的结构分析,有关 的说法正确的是( )
的说法正确的是( )