题目内容
开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)甲烷水蒸气转化法制H2的主要转化反应如下:
CH4(g) + H2O(g) CO(g) + 3H2(g)? △H=+206.2 kJ·mol-1
CO(g) + 3H2(g)? △H=+206.2 kJ·mol-1
CH4(g) + 2H2O(g) CO2(g) + 4H2(g)? △H=+165.0 kJ·mol-1
CO2(g) + 4H2(g)? △H=+165.0 kJ·mol-1
上述反应所得原料气中的CO能使合成氨的催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是??????? 。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g)? ΔH>0
CO(g) + 3H2(g)? ΔH>0
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为___________。(填“<”、“>”、“=” );

②100℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是__________
a.容器内气体密度恒定??
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定??????
d.3v正(CH4) = v逆(H2)
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____。

A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(Na+)=0.1mol/L
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与水反应得到HF和化合物A,该反应的化学方程式为????????????????????? 。
(1) CO(g) + H2O(g) CO2(g) + H2(g)? △H=-41.2 kJ·mol-1?????? (2分)
CO2(g) + H2(g)? △H=-41.2 kJ·mol-1?????? (2分)
(2)① KC = KB >KA??? ? (2分)
② cd???? (2分)
(3)BC??? (2分)
(4)H2O+HFO=HF+H2O2? (2分)
【解析】
试题分析:(1) 先对已知热化学方程式编号为①②,观察发现②-①可得,CO(g) + H2O(g) CO2(g) + H2(g)? △H=-41.2 kJ·mol-1;
CO2(g) + H2(g)? △H=-41.2 kJ·mol-1;
(2)① 平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,化学平衡常数只与温度有关,所以B、C两点是相同的温度,所以KC = KB,然后A、B两点相比,从A到B,甲烷的转化率变大,说明向正向移动,化学平衡常数变大,所以KB>KA ,所以答案是KC = KB >KA;
② 该容器的体积保持不变,根据质量守恒定律知,反应前后混合气体的质量不变,所以容器内气体的密度不变,所以不能表明达到化学平衡状态,故a错误;单位时间内消耗0.1 mol CH4同时生成0.3 mol H2,都代表v正,所以不能表明达到化学平衡状态,故b错误;随反应进行混合气体总物质的量增大,容器容积不变,压强增大,当容器的压强恒定时,说明到达平衡,故c正确;3v正(CH4) = v逆(H2),物质的正逆速率之比等于化学计量数之比,反应到达平衡,故d正确,所以选cd;
(3)pH=3的HF溶液,由水电离出的c(H+)=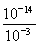 =10-11mol·L-1,pH=11的NaF溶液中,由水电离出的c(H+)=10-14/10-11=10-3mol·L-1,A错;①点时,根据电子守恒,c(OH-)+c(F-)=c(Na+)+c(H+),c(F-)-c(Na+)=c(H+)-c(OH-)=10-6-
=10-11mol·L-1,pH=11的NaF溶液中,由水电离出的c(H+)=10-14/10-11=10-3mol·L-1,A错;①点时,根据电子守恒,c(OH-)+c(F-)=c(Na+)+c(H+),c(F-)-c(Na+)=c(H+)-c(OH-)=10-6- =9.9×10-7mol/L,B对;根据电子守恒,c(OH-)+c(F-)=c(Na+)+c(H+),②点时pH=7,溶液中的c(H+)-c(OH-),所以c(F-)=c(Na+),C对;③点时V=20mL,此时溶液中c(Na+)=
=9.9×10-7mol/L,B对;根据电子守恒,c(OH-)+c(F-)=c(Na+)+c(H+),②点时pH=7,溶液中的c(H+)-c(OH-),所以c(F-)=c(Na+),C对;③点时V=20mL,此时溶液中c(Na+)= =0.05mol/L,所以选BC;
=0.05mol/L,所以选BC;
(4)电负性F>O,故H-O-F中F元素表现-1价,与水反应生成HF,发生水解反应,可推知A为H-O-O-H,该反应的化学方程式为:H2O+HFO=HF+H2O2。
考点:考查热化学方程式、化学平衡图象及影响因素、平衡常数、平衡状态判断、弱电解质的电离、离子浓度比较等。

 CO(g)
+ 3H2(g) ΔH>0
CO(g)
+ 3H2(g) ΔH>0