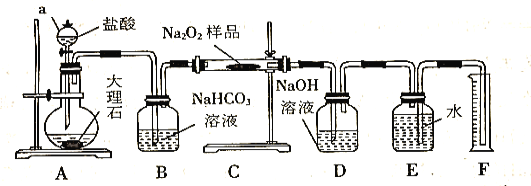
��Ŀ����
����Ŀ����27.2g Cu��Cu2O�Ļ�����м���ijŨ�ȵ�ϡ����0.5L������������ȫ��Ӧ������NO��Cu(NO3)2����������Һ�м���1.0mol/L��NaOH��Һ1.0L����ʱ��Һ�����ԡ�������������ȫ��������������Ϊ39.2g�������й�˵������ȷ����( )
A. Cu��Cu2O�����ʵ���֮��Ϊ2��1
B. ������NO�ڱ�״���µ����Ϊ4.48L
C. ��������ʵ���Ũ��Ϊ2.6mol/L
D. Cu��Cu2O�����ᷴӦ��ʣ��HNO3Ϊ0.2mol
���𰸡�C
��������
��������Һ�м���1.0mol/L ��NaOH��Һ1.0 L����ʱ��Һ�����ԣ�������������ȫ��������Һ������ΪNaNO3��n(NaNO3) = n(NaOH) = 1.0 mol/L��1.0 L=1 mol������ΪCu(OH)2������Ϊ39.2 g������������ʵ���= ![]() = 0.4 mol���ٸ���ͭԪ���غ���n(Cu)+2n(Cu2O) = n[Cu(OH)2]�����Է�Ӧ�����Һ��n[[Cu(NO3)2] = n[Cu(OH)2] = 0.4 mol��
= 0.4 mol���ٸ���ͭԪ���غ���n(Cu)+2n(Cu2O) = n[Cu(OH)2]�����Է�Ӧ�����Һ��n[[Cu(NO3)2] = n[Cu(OH)2] = 0.4 mol��
A. ��Cu��Cu2O�����ʵ����ֱ�Ϊx mol��y mol�����ݶ�����������ϵʽn(Cu)+2n(Cu2O) = n[Cu(OH)2]���з��̼��㣻
B. ����A�����Cu��Cu2O�����ʵ��������õ���ת���غ����n(NO)���ٸ���V=n��Vm����NO�������
C. ����NԪ���غ��֪ԭ������Һn(HNO3) = n(NO) + n(NaNO3)������A�����Cu��Cu2O�����ʵ��������õ���ת���غ����n��NO��������NaԪ�ؿ�֪n��NaNO3��=n��NaOH�����ٸ���c = ![]() �����㣻
�����㣻
D. ��Ӧ�����Һ�м�������������Һ����������������ͭ�����ᷴӦ�����Ϊ��������Һ�����ݵ�Ԫ���غ��֪��Ӧ����Һ��n(HNO3) ʣ��+ 2n[[Cu(NO3)2] = n(NaNO3)���ݴ˼��㡣
A. ��Cu��Cu2O�����ʵ����ֱ�Ϊx mol��y mol�����ݶ��������� 64 x+144 y = 27.2������ͭԪ���غ���x + 2y = 0.4���������̽��x = 0.2��y = 0.1������n(Cu)��n(Cu2O) = 0.2��0.1 = 2��1����A����ȷ��
B.���ݵ���ת���غ��֪��3n(NO) = 2n(Cu) + 2n(Cu2O)������3n(NO) = 2��0.2 mol + 2��0.1 mol�����n(NO) = 0.2 mol�����Ա�״����NO�����Ϊ0.2 mol��22.4 L/mol = 4.48 L����B����ȷ��
C. ����NԪ���غ��֪n(HNO3) = n(NO) + n(NaNO3)�����ݵ���ת���غ��֪��3n(NO) = 2n(Cu) + 2n(Cu2O)������3n(NO) = 2��0.2 mol + 2��0.1 mol�����n(NO) = 0.2 mol������NaԪ�ؿ�֪n(NaNO3) = n(NaOH) = 1.0 mol/L��1.0 L=1 mol������n(HNO3) = n(NO) + n(NaNO3) = 0.2 mol+1 mol = 1.2 mol������ԭ������Һ��Ũ��Ϊ![]() = 2.4 mol/L����C�����
= 2.4 mol/L����C�����
D. ��Ӧ�����Һ�м�������������Һ����������������ͭ�����ᷴӦ�����Ϊ��������Һ�����ݵ�Ԫ���غ��֪��Ӧ����Һ��n(HNO3)ʣ�� + 2n[Cu(NO3)2] = n(NaNO3)������n(HNO3) ʣ��= n(NaNO3) - 2n[Cu(NO3)2]=1 mol-2��0.4mol = 0.2 mol����D����ȷ��
��ѡC��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�