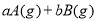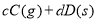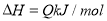题目内容
许多硫的含氧酸盐在医药、化工等方面有着重要的用途。
(1)重晶石(BaSO4)常做胃肠道造影剂。已知:常温下,Ksp(BaSO4)=1.1×10-10。向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)= ;
(2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]常做分析剂。等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2 b.NH4HSO4 c.(NH4)2SO4 d.(NH4)2SO3
其中c(NH4+)由大到小的顺序为 (填选项字母);
(3)过二硫酸钾(K2S2O8)常做强氧化剂,Na2S2O3常做还原剂。
①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为 ;
②样品中K2S2O8的含量可用碘量法测定。操作步骤为称取0.3000 g样品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以 为指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定至终点(已知:I2+2S2O32- = 2I-+S4O62-)。重复2次,测得平均消耗标准液21.00 mL。该样品中K2S2O8的质量分数为(杂质不参加反应) _(结果保留三位有效数字)。
(1)2.2×10-8mol/L( 未写单位不得分) (2)a>c>d>b
(2)①5S2O32-+2Mn2++8H2O 10SO42-+2MnO4-+16H+ (没写反应条件给分)
10SO42-+2MnO4-+16H+ (没写反应条件给分)
②淀粉 94.5%
【解析】
试题分析:(1)Ksp(BaSO4)=1.1×10-10,当溶液的pH=2时,c(SO42-) =0.005 mol/L ,c(Ba2+)= Ksp(BaSO4)/ c(SO42-)=2.2×10-8mol/L ;
(2)等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2 ,c.(NH4)2SO4 ,d.(NH4)2SO3 中NH4+浓度大于b.NH4HSO4 ,a.Fe2+ 和NH4+水解相互抑制,d. NH4+和SO32-水解相互促进。所以c(NH4+)由大到小的顺序为a>c>d>b;
(3)过二硫酸钾(K2S2O8)常做强氧化剂,①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,Mn2+被氧化成MnO4-,S2O82-被还原,5S2O32-+2Mn2++8H2O 10SO42-+2MnO4-+16H+,②因为该反应涉及I2,可以用淀粉溶液作指示剂;由I2+2S2O32- = 2I-+S4O62- 得关系: n(S2O82-)--2n(S2O32-);已知n(S2O32-)=2.1×10-3mol; 求得n(S2O82-)=1.05×10-3mol;w(K2S2O8)=270g/mol×1.05×10-3mol /0.3g×100℅=94.5%
10SO42-+2MnO4-+16H+,②因为该反应涉及I2,可以用淀粉溶液作指示剂;由I2+2S2O32- = 2I-+S4O62- 得关系: n(S2O82-)--2n(S2O32-);已知n(S2O32-)=2.1×10-3mol; 求得n(S2O82-)=1.05×10-3mol;w(K2S2O8)=270g/mol×1.05×10-3mol /0.3g×100℅=94.5%
考点:溶度积常数的计算及氧化还原反应的分析和计算