题目内容
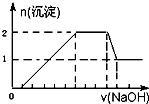 某无色溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子中的几种,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列说法一定正确的是( )
某无色溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子中的几种,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列说法一定正确的是( )| A、一定存在H+、Mg2+、Al3+、NH4+,一定不存在Na+、SO42-、Fe3+ | B、一定存在H+、Al3+、NH4+、SO42-,可能存在Na+、Mg2+ | C、溶液中c(H+):c(Al3+):c(Mg2+)为1:1:1 | D、溶液中c(H+):c(SO42-)为2:9 |
分析:开始加入NaOH没有沉淀和气体产生,则一定有H+,后来有沉淀产生且最后减少,没有消失,则一定有Mg2+、Fe3+中的至少一种,一定有有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3?H2O的反应,则有NH4+,根据离子反应发生的条件进行判断及用相关化学方程式进行计算.
解答:解:从图象可知,开始时无沉淀产生,说明含有H+,H++OH-=H2O,该氢离子消耗NaOH溶液的体积为1体积,图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3?H2O,铵根消耗氢氧化钠为3体积,最后溶液中仍存在沉淀,说明溶液中含有Al3+,Al3++3 OH-=Al(OH)3↓,铝离子消耗NaOH溶液的体积为3体积,当消耗4体积的氢氧化钠时沉淀消失,在沉淀的产生过程中,消耗3体积的氢氧化钠将铝离子沉淀,形成氢氧化铝是1mol,含有Al3+是1mol,所以还有2体积的氢氧化钠应该适用于镁离子的沉淀,沉淀量的最大值是2mol,所以含有Mg2+是1mol,所以溶液中一定含有H+、Al3+、NH4+、Mg2+,一定含有的阴离子是SO42-.
A、根据分析知道该溶液中一定存在H+、Mg2+、Al3+、NH4+、SO42-,其他离子不能确定,故A错误;
B、根据分析知道该溶液中一定存在H+、Mg2+、Al3+、NH4+、SO42-,可能存在Na+,一定不存在Fe3+,故B错误;
C、溶液中含有的H+、Mg2+、Al3+的物质的量均是1mol,所以浓度是相等的,即c(H+):c(Al3+):c(Mg2+)为1:1:1,故C正确;
D、该溶液中一定存在H+、Mg2+、Al3+、NH4+、SO42-,H+、Mg2+、Al3+、NH4+的物质的量分别是1mol、1mol、1mol、3mol,因为钠离子不知道是否存在,所以不能根据电荷守恒来确定硫酸根离子的物质的量,故D错误.
故选C.
A、根据分析知道该溶液中一定存在H+、Mg2+、Al3+、NH4+、SO42-,其他离子不能确定,故A错误;
B、根据分析知道该溶液中一定存在H+、Mg2+、Al3+、NH4+、SO42-,可能存在Na+,一定不存在Fe3+,故B错误;
C、溶液中含有的H+、Mg2+、Al3+的物质的量均是1mol,所以浓度是相等的,即c(H+):c(Al3+):c(Mg2+)为1:1:1,故C正确;
D、该溶液中一定存在H+、Mg2+、Al3+、NH4+、SO42-,H+、Mg2+、Al3+、NH4+的物质的量分别是1mol、1mol、1mol、3mol,因为钠离子不知道是否存在,所以不能根据电荷守恒来确定硫酸根离子的物质的量,故D错误.
故选C.
点评:本题考查离子的判断和计算,题目难度中等,要求学生熟记物质的性质并灵活应用.

练习册系列答案
相关题目