题目内容
某无色溶液中可能含有Na+、K+、Fe3+、NH4+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br-这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①pH试纸检验,溶液的pH>7.②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成.③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液.④向分液后的水溶液中加入Ba(NO3)2溶液和HNO3溶液,有白色沉淀产生,过滤.⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生.则关于原溶液的判断中不正确的是( )
分析:①pH试纸检验,溶液的pH>7,证明溶液显示碱性,②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成,则一定不存在硫酸根离子,③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,则为溴水的颜色,一定不含有碳酸根离子,④向分液后的水溶液中加入Ba(NO3)2溶液和HNO3溶液,有白色沉淀产生,可以证明亚硫酸根离子的存在,⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生,即为氯化银沉淀.
解答:解:某无色溶液中一定不存在:Fe3+、Cu2+,①pH试纸检验,溶液的pH>7,证明溶液显示碱性,一定含有钠离子或是钾离子中的至少一种,②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成,则一定不存在硫酸根离子,③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,则一定不含CO32-,可能含有SO32-,亚硫酸根能被溴水氧化为硫酸根离子,再加入CCl4振荡,静置后CCl4层呈橙色,则为溴水的颜色,一定含有溴离子,④向分液后的水溶液中加入Ba(NO3)2溶液和HNO3溶液,有白色沉淀产生,可以证明硫酸根离子的存在,即是亚硫酸根被氧化生成的硫酸根离子,一定不存在铵根离子,因为二者会双水解而不共存,⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生,即为氯化银沉淀,但是在③中加入的氯水中含有氯离子,不能确定是否存在待测离子中的氯离子.
A、肯定存在的离子是SO32-、Br-,还有Na+、K+中的至少一种,故A错误;
B、肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32-,故B正确;
C、在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生,即为氯化银沉淀,但是在③中加入的氯水中含有氯离子,不能确定是否存在待测离子中的氯离子,故C正确;
D、若步骤④改用BaCl2溶液和盐酸的混合溶液,则硫酸根离子会和BaCl2溶液反应生成难溶物质硫酸钡,但是硫酸根一定是亚硫酸根离子被氧化来的,此时对溶液中离子的判断无影响,故D正确.
故选A.
A、肯定存在的离子是SO32-、Br-,还有Na+、K+中的至少一种,故A错误;
B、肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32-,故B正确;
C、在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生,即为氯化银沉淀,但是在③中加入的氯水中含有氯离子,不能确定是否存在待测离子中的氯离子,故C正确;
D、若步骤④改用BaCl2溶液和盐酸的混合溶液,则硫酸根离子会和BaCl2溶液反应生成难溶物质硫酸钡,但是硫酸根一定是亚硫酸根离子被氧化来的,此时对溶液中离子的判断无影响,故D正确.
故选A.
点评:本题考查离子的检验,物质的检验是化学的重难点,也是考试的热点之一,了解物质或离子的化学性质是本题解题的关键,综合性较强,难度大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
(2011?河西区一模)某无色溶液中可能含有 ①Na+、②Ba2+、③Cl-、④Br-、⑤SO42-、⑥SO32-离子中的若干种,依顺序进行下列实验,且每步所加试剂均过量,观察到的现象如下:
|
某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液呈无色,则下列关于溶液组成的判断正确的是( )
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32-④可能含有I-.
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32-④可能含有I-.
| A、①③ | B、①②③ | C、③④ | D、②③④ |
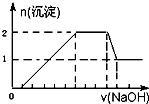 某无色溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子中的几种,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列说法一定正确的是( )
某无色溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子中的几种,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列说法一定正确的是( )| A、一定存在H+、Mg2+、Al3+、NH4+,一定不存在Na+、SO42-、Fe3+ | B、一定存在H+、Al3+、NH4+、SO42-,可能存在Na+、Mg2+ | C、溶液中c(H+):c(Al3+):c(Mg2+)为1:1:1 | D、溶液中c(H+):c(SO42-)为2:9 |