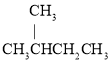题目内容
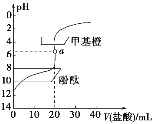
【题目】常温下,用0.1 mol·L-1的盐酸滴定20 mL约0.1 mol·L-1的氨水,滴定曲线如图所示,下列说法正确的是( )
A.a点溶液中:c(H+)=c(OH-)+c(NH3·H2O)
B.滴定过程中,当溶液pH=7时,二者恰好中和
C.用酚酞作指示剂比用甲基橙作指示剂滴定误差更小
D.当滴入盐酸为30mL时,溶液中:c(H+)+c(NH4+)<c(OH-)+c(Cl-)
【答案】A
【解析】
A. 根据滴定曲线可知:当加入盐酸20 mL时二者恰好反应产生NH4Cl,此时NH4+水解使溶液使溶液显酸性,溶液的pH=6。根据质子守恒可知溶液中c(H+)=c(OH-)+c(NH3·H2O),A正确;
B. 用盐酸滴定氨水,当二者恰好反应时溶液为NH4Cl,该盐是强酸弱碱盐,NH4+水解使溶液显酸性,溶液的pH=6,所以当溶液pH=7时,说明滴加的盐酸不足量,氨水过量,此时二者并未恰好中和,B错误;
C. 盐酸与氨水反应产生的盐NH4Cl能发生水解,使溶液显酸性,滴定时,使用酸性范围内变色的指示剂甲基橙要比使用碱性范围内变色的指示剂酚酞的滴定误差更小,C错误;
D. 当滴入盐酸为30 mL时,盐酸过量,溶液中溶质为HCl和NH4Cl,二者的物质的量的比为1:2,根据电荷守恒可得:c(H+)+c(NH4+)=c(OH-)+c(Cl-),D错误;
故合理选项是A。

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目