题目内容
向一个容积为4L的密闭容器中充入7molSO2和4molO2,在一定温度和压强下,发生如下反应:2SO2(g)+O2(g)  2SO3(g),经4s后达到平衡状态,测得SO2的物质的量是3mol,计算:
2SO3(g),经4s后达到平衡状态,测得SO2的物质的量是3mol,计算:
(1)以O2表示的该反应的速率
(2)平衡时SO3的物质的量浓度
 2SO3(g),经4s后达到平衡状态,测得SO2的物质的量是3mol,计算:
2SO3(g),经4s后达到平衡状态,测得SO2的物质的量是3mol,计算:(1)以O2表示的该反应的速率
v(O2)=0.125mol?L-1?s-1
v(O2)=0.125mol?L-1?s-1
(2)平衡时SO3的物质的量浓度
c(SO3)=4mol/L
c(SO3)=4mol/L
.分析:(1)根据v=
求出v(SO2),再利用速率之比等于化学计量数之比,计算v(O2);
(2)根据方程式,计算出SO3的物质的量,再利用c=
计算SO3的物质的量浓度.
| △c |
| △t |
(2)根据方程式,计算出SO3的物质的量,再利用c=
| n |
| V |
解答:解:(1)以SO2表示的该反应的速率v(SO2)=
=0.25mol?L-1?s-1,速率之比等于化学计量数之比,所以有:
v(O2)=
v(SO2)=
×0.25mol?L-1?s-1=0.125mol?L-1?s-1;
故答案为:0.125mol?L-1?s-1
(2)参加反应的SO2的物质的量为7mol-3mol=4mol,根据方程式2SO2(g)+O2(g)?2SO3(g)可知,生成的SO3的物质的量等于参加反应的SO2的物质的量,平衡时SO3的物质的量浓度为c(SO3)=
=1mol/L.
故答案为:1mol/L
| ||
| 4s |
v(O2)=
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:0.125mol?L-1?s-1
(2)参加反应的SO2的物质的量为7mol-3mol=4mol,根据方程式2SO2(g)+O2(g)?2SO3(g)可知,生成的SO3的物质的量等于参加反应的SO2的物质的量,平衡时SO3的物质的量浓度为c(SO3)=
| 4mol |
| 4L |
故答案为:1mol/L
点评:本题考查了化学平衡的有关计算,难度不大,O2表示的该反应的速率可以用定义法也可以用化学计量法,化学计量法比定义法稍简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

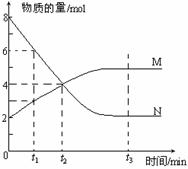 (2)在图上所示的三个时刻中, (填t1、t2或t3)时刻处于平衡状态,此时V正 V逆(填>、<或=,);达到平衡状态后,平均反应速率v(N)v(M)= 。
(2)在图上所示的三个时刻中, (填t1、t2或t3)时刻处于平衡状态,此时V正 V逆(填>、<或=,);达到平衡状态后,平均反应速率v(N)v(M)= 。 2SO3(g),经4s后达到平衡状态,测得SO2的物质的量是3mol,计算:
2SO3(g),经4s后达到平衡状态,测得SO2的物质的量是3mol,计算: