题目内容
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊。 | 碳酸的酸性比苯酚的强 |
B | 室温下,向浓度均为0.1 mol·L–1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。 | Fe3+的氧化性比I2的强 |
D | 室温下,用pH试纸测得:0.1mol·L–1 Na2SO3溶液的pH约为10;0.1mol·L–1 NaHSO3溶液的pH约为5。 | HSO3–结合H+的能力比 SO32–的强 |
【答案】AC
【解析】A、室温下,向苯酚钠溶液中通入足量CO2,发生反应:![]() + CO2 + H2O
+ CO2 + H2O ![]()
![]() + NaHCO3,说明碳酸的酸性比苯酚的强,A正确;B、硫酸钙为微溶物、硫酸钡为难溶物,均能形成白色沉淀,但题给实验无法判断二者的Ksp大小,B错误;C、室温下,向FeCl3溶液中滴加少量KI溶液,发生反应:2Fe3++2I–===2Fe2++I2,Fe3+的氧化性比I2的强,C正确;D、亚硫酸氢钠溶液显酸性,这说明亚硫酸氢根离子的电离程度大于其水解程度,因此题给实验说明HSO3–结合H+的能力比SO32–的弱,D错误。答案选AC。
+ NaHCO3,说明碳酸的酸性比苯酚的强,A正确;B、硫酸钙为微溶物、硫酸钡为难溶物,均能形成白色沉淀,但题给实验无法判断二者的Ksp大小,B错误;C、室温下,向FeCl3溶液中滴加少量KI溶液,发生反应:2Fe3++2I–===2Fe2++I2,Fe3+的氧化性比I2的强,C正确;D、亚硫酸氢钠溶液显酸性,这说明亚硫酸氢根离子的电离程度大于其水解程度,因此题给实验说明HSO3–结合H+的能力比SO32–的弱,D错误。答案选AC。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案【题目】利用下图所示装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测其中现象正确的是

选项 | a | b | c | c试管中现象 |
A | 浓盐酸 | KMnO4 | FeCl2溶液 | 溶液变棕黄色 |
B | 稀硫酸 | Na2S2O3 | 溴水 | 产生浅黄色沉淀 |
C | 硼酸 | Na2CO3 | Na2SiO3溶液 | 析出白色沉淀 |
D | 浓硝酸 | 铁片 | KI-淀粉溶液 | 溶液变蓝色 |
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的溶液易被催化分解,写出其化学方程式_________________。
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为_______________________________,
N→⑥的单质的化学方程式为______________________________________。
【题目】用右图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
【题目】下列实验对应的现象及结论均正确,且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 向稀硝酸与过量铜粉反应后的溶液中滴加稀硫酸 | 有气泡生成 | 常温下,铜与稀硫酸反应生成SO2 |
B | 在酒精灯上加热铝箔 | 铝熔化,但熔化的铝不滴落 | Al2O3的熔点比Al高 |
C | 向Fe(SCN)3溶液中滴加稀NaOH溶液 | 溶液有红色变为红褐色 | 减小反应物浓度、平衡向逆反应方向移动 |
D | 选用酚酞作试剂,用NaOH溶液滴定醋酸溶液 | 溶液变为粉红色 | NaOH溶液过量 |
【题目】足量锌与浓H2SO4充分在加热下反应生成会SO2和H2的混合气体;锌和稀硫酸反应只有H2生成。现有甲乙两研究小组分别实验探究:
(1)甲研究小组按下图实验验证锌与浓硫酸反应生成物中SO2和H2,取少量的Zn置于b中,向a中加入100mL18.5mol·L-1的浓硫酸,经过一段时间反应,Zn完全溶解
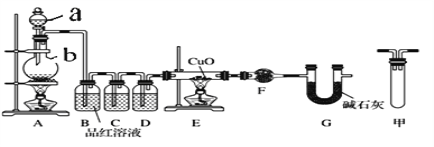
①填写仪器名称:a_____________、b_________。
②写出装置A中生成能使品红溶液褪色的化学反应方程式:_________________。
③装置D中加入的试剂是__________。
④U型管G的作用为______________。
⑤有同学认为A、B间应增加图中的甲装置,该装置的作用为__________。
⑥证明反应生成SO2和H2的实验现象是_________________。
⑦若A中生成标准状况下的气体33.6L,将A反应后的溶液稀释到1L,测得溶液中H+的浓度为0.1 mol·L-1,则稀释液中SO42-的物质的量浓度是_________ mol·L-1。
(2)乙研究小组为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行以下实验,分析影响反应速率的因素。

实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示:
1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
分析反应过程中的水滴数,请回答:
① 由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快,主要原因是形成原电池反应速度快。
② 由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是_____________________________________。
③ 从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是:_______。