题目内容
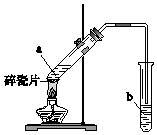
18. FeCl2是一种常见的还原剂,实验室可以用H2还原无水FeCl3制取(如图).
FeCl2是一种常见的还原剂,实验室可以用H2还原无水FeCl3制取(如图).(1)A 中反应的化学方程式为H2+2FeCl3$\frac{\underline{\;加热\;}}{\;}$2FeCl2+2HCl.
(2)装置B的作用是吸收氯化氢气体,防止空气污染;或防止空气中的水分进入.
(3)若通入H2量不足或温度控制不当,产品中会有杂质FeCl3,检验产品中是否含有FeCl3的实验方案是取少量样品用稀盐酸溶解,滴加硫氰化钾试液,若有血红色出现说明产品中有FeCl3杂质.
分析 加热条件下,氢气与氯化铁发生氧化还原反应生成FeCl2,方程式为H2+2FeCl3$\frac{\underline{\;加热\;}}{\;}$2FeCl2+2HCl,碱石灰用于吸收氯化氢,并防止空气中的水进入,避免氯化铁的水解,以此解答该题.
解答 解:(1)加热条件下,氢气与氯化铁发生氧化还原反应生成FeCl2,方程式为H2+2FeCl3$\frac{\underline{\;加热\;}}{\;}$2FeCl2+2HCl,
故答案为:H2+2FeCl3$\frac{\underline{\;加热\;}}{\;}$2FeCl2+2HCl;
(2)尾气中含有氯化氢,氯化氢可与碱石灰反应,则碱石灰可吸收氯化氢气体,防止空气污染;或防止空气中的水分进入,
故答案为:吸收氯化氢气体,防止空气污染;或防止空气中的水分进入;
(3)可用检验铁离子的方法检验氯化铁,方法是取少量样品用稀盐酸溶解,滴加硫氰化钾试液,若有血红色出现说明产品中有FeCl3杂质,
故答案为:取少量样品用稀盐酸溶解,滴加硫氰化钾试液,若有血红色出现说明产品中有FeCl3杂质.
点评 本题考查实验室制备氯化亚铁的方案设计与评价,为高频考点,侧重考查学生的分析能力和实验能力,题目难度不大,本题注意把握实验操作原理,把握题给信息,掌握实验操作方法,学习中注意积累.

练习册系列答案
相关题目
14. 利用CO和H2在催化剂的作用下合成甲醇,反应如下:CO(g)+2H2(g)?CH3OH(g).在2L密闭容器中充入物质的量之比为1:2的CO和H2,在催化剂作用下充分反应,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法正确的是( )
利用CO和H2在催化剂的作用下合成甲醇,反应如下:CO(g)+2H2(g)?CH3OH(g).在2L密闭容器中充入物质的量之比为1:2的CO和H2,在催化剂作用下充分反应,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法正确的是( )
 利用CO和H2在催化剂的作用下合成甲醇,反应如下:CO(g)+2H2(g)?CH3OH(g).在2L密闭容器中充入物质的量之比为1:2的CO和H2,在催化剂作用下充分反应,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法正确的是( )
利用CO和H2在催化剂的作用下合成甲醇,反应如下:CO(g)+2H2(g)?CH3OH(g).在2L密闭容器中充入物质的量之比为1:2的CO和H2,在催化剂作用下充分反应,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法正确的是( )| A. | 该反应的△H<0,且p1<p2<p3 | |
| B. | 在C点时,H2转化率为75% | |
| C. | 反应速率:ν逆(状态A)>ν逆(状态B) | |
| D. | 在恒温恒压条件下,向该密闭容器中再充入1molCH3OH,达平衡时CH3OH的体积分数增大 |
6.下表中列出了25℃、101kPa时一些物质的燃烧热数据
已知键能:C-H键:413kJ/mol、H-H键:436.0kJ/mol,乙炔的结构是为H-C≡C-H.则下列叙述正确的是( )
| 物质 | CH4 | C2H2 | H2 |
| 燃烧热/(kJ/mol) | 890.3 | 1299.6 | 285.8 |
| A. | 2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ/mol | |
| B. | CH4和C2H2中所含化学键完全相同 | |
| C. | 2CH4(g)═C2H2(g)+3H2(g)△H=-376.4kJ/mol | |
| D. | C≡C键能为796.0kJ/mol |
13.下列说法正确的是( )
| A. | 硬脂酸甘油酯皂化反应后得到的主要产品是硬脂酸和甘油 | |
| B. | 氨基酸为高分子化合物,种类较多,分子中都含有-COOH和-NH2 | |
| C. | 鸡蛋清中加入浓的食盐水可以杀菌消毒,发生了蛋白质变性 | |
| D. | 葡萄糖与银氨溶液或含氢氧化钠的氢氧化铜悬浊液的反应可用于检验葡萄糖的存在 |
3.下列关于化学键及晶体的说法中,正确的是( )
| A. | 分子晶体中一定含有共价键,离子晶体中可能含有共价键 | |
| B. | 原子或离子之间强烈的相互吸引作用叫做化学键 | |
| C. | 金刚石、石墨、足球烯互为同素异形体,但晶体类型不同 | |
| D. | HCl溶于水能电离出氢离子和氯离子,故HCl是离子化合物 |
2.为研究沉淀的生成及其转化,某小组进行如下实验.关于该实验的分析不正确的是( )

| A. | ①浊液中存在平衡:Ag2CrO4(s)?2Ag+(aq)+CrO42-(aq) | |
| B. | ②中溶液变澄淸原因:AgOH+2NH3•H2O═[Ag(NH3)2]OH+2H2O | |
| C. | ③中顔色变化说明有AgCl生成 | |
| D. | 该实验可以证明AgCl比Ag2CrO4更难溶 |
3.下列说法中,正确的是( )
| A. | 煤和石油主要组成元素均为碳、氢元素,二者都是混合物 | |
| B. | 煤的干馏和石油的分馏原理相同,都是化学变化 | |
| C. | 煤的液化主要是为了得到苯等重要的有机化工原料 | |
| D. | 煤的气化是物理变化,目的是获取高效、清洁的燃料 |
 实验室用如图所示装置制备乙酸乙酯.
实验室用如图所示装置制备乙酸乙酯. 


