题目内容
【题目】将绿矾(FeSO4·7H2O)、硫酸铵以相等物质的量混合可制得莫尔盐晶体。(NH4)2SO4+FeSO4+6H2O= (NH4)2SO4·FeSO4·6H2O↓,根据下图回答: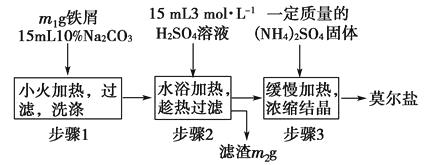
(1)步骤2中铁屑过量的目的是。
(2)步骤3中,加入(NH4)2SO4固体后,要得到莫尔盐晶体,需经过的实验操作包括:加热蒸发、、。浓缩时能否蒸发至干,为什么?。
(3)步骤3中制得的晶体过滤后用无水乙醇洗涤的目的是;
不用蒸馏水洗涤,理由是。
【答案】
(1)防止Fe2+被氧化成Fe3+:Fe+2Fe3+=3Fe2+
(2)冷却结晶;过滤;不能,因为蒸干时溶液中的杂质离子会被带入晶体中;蒸干时晶体会受热分解或被氧化
(3)利用乙醇的挥发,除去晶体表面附着的水分;①减少晶体在洗涤时的溶解;②减少蒸馏水中溶解氧对晶体的氧化
【解析】(1)剩下一点铁屑,可以还原氧化生成的Fe3+ , 保证Fe2+稳定、纯净地存在,减少产物中的Fe3+杂质。Fe+2Fe3+=3Fe2+。(2)浓缩结晶莫尔盐时要用小火加热,加热浓缩初期可轻微搅拌,但注意观察晶膜,若有晶膜出现,则停止加热,防止莫尔盐失水。更不能蒸发至干,蒸干时溶液中的杂质离子会被带入晶体中,晶体可能会受热分解或被氧化。(3)洗涤莫尔盐用无水乙醇,不能用水。莫尔盐不溶于乙醇,但易溶于水,用无水乙醇可以除去水,易于干燥。

练习册系列答案
相关题目