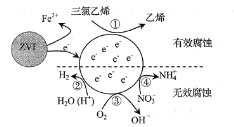
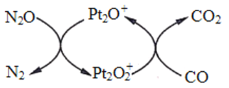
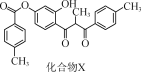
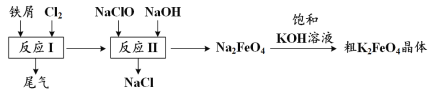题目内容
【题目】已知 443℃时: 2HI(g)H2(g) +I2(g) ΔH = +12.5 kJ·mol-1 ,443℃时,向 1L 密闭容器中充入 1 mol HI,体系中 c(HI)与反应时间 t 的关系如下图所示。下列说法中,正确的是
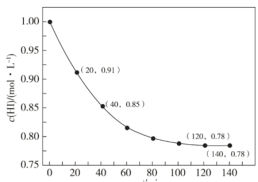
A.反应进行 40 min 时,体系吸收的热量约为 0.9375 kJ
B.升高温度,再次平衡时,c(HI) > 0.78 mol·L-1
C.0~20 min 内的平均反应速率可表示为υ(H2) = 0.0045 mol·L-1·min-1
D.该反应的化学平衡常数计算式为![]()
【答案】A
【解析】
A.从表中可知,反应进行 40 min 时,c(HI)=0.85mol/L,参加反应的c(HI)=0.15mol/L,体系吸收的热量约为![]() =0.9375 kJ,A正确;
=0.9375 kJ,A正确;
B.升高温度,由于ΔH >0,所以平衡正向移动,再次平衡时,c(HI)<0.78 mol·L-1,B不正确;
C.从表中可以看出,反应至20min时,c(HI)=0.91mol/L,则生成c(H2)=0.045mol/L, 0~20 min 内的平均反应速率可表示为υ(H2) =![]() =0.00225 mol·L-1·min-1,C不正确;
=0.00225 mol·L-1·min-1,C不正确;
D.该反应平衡时,c(HI)=0.78mol/L,则c(H2)= c(I2)=0.11mol/L,化学平衡常数计算式为![]() =
=![]() ,D不正确;
,D不正确;
故选A。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目