题目内容
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,其合成反应为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1)下表列出了一些化学键断裂需要的能量数据,则CO(g)+2H2(g)![]() CH3OH(g) △H=________。
CH3OH(g) △H=________。
化学键 | H-H | C-O | C | H-O | C-H |
E(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
工业上用天然气为原料合成甲醇,分为两阶段。
I制备合成气:CH4+H2O(g)=CO+3H2。
(2)为解决合成气中H2过量CO不足问题,原料气中添加CO2,发生反应CO2+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为___ 。
Ⅱ合成甲醇
实验室进行模拟合成实验。将1 molCO和2molH2通人密闭容器中,测得CO在不同温度下的平衡转化率与压强的关系如图所示:
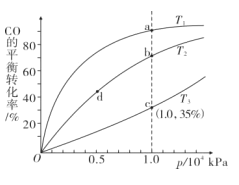
(3)比较T1、T2、T3的大小,并说明理由____。
(4)平衡常数K(b)___ K(d)、正反应速率v(a) ___v(b)(均填“大于”“小于”或“等于”)。
(5)c点时反应的压强平衡常数Kp=___ (kPa)-2(用数字表达式表示,Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(6)a点时,保持温度不变,将密闭容器的容积压缩刮原来的,对平衡体系产生的影响是______。
A. c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加 D.重新平衡时![]() 减小
减小![]() E. CH3OH的体积分数增加
E. CH3OH的体积分数增加
(7)科研人员设计了一种新型甲醇燃料电池,其电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,该电池工作时的负极电极反应式为 ________。
【答案】 -99kJ/mol 3:1 T1<T2<T3 该正反应放热,温度升高平衡逆向移动,CO的平衡转化率减小 等于 小于 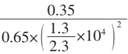 CDE CH3OH-6e-+302-=CO2↑+2H2O
CDE CH3OH-6e-+302-=CO2↑+2H2O
【解析】(1)根据△H=反应物断键吸收的总能量-生成物成键放出的总能量=1076+2×436-(3×413+343+465)=-99kJ/mol;正确答案:-99kJ/mol。
I (2) 由![]()
![]()
![]() 可以知道,理论上一氧化碳与氢气按
可以知道,理论上一氧化碳与氢气按![]() 进行反应,由反应
进行反应,由反应![]()
![]()
![]() 可以知道
可以知道![]() 甲烷生成
甲烷生成![]() 与
与![]() ,
,![]() 过量
过量![]() ,过量的氢气由二氧化碳反应,根据反应
,过量的氢气由二氧化碳反应,根据反应![]()
![]()
![]() 可以知道
可以知道![]() 需二氧化碳
需二氧化碳![]() ,所以理论上原料气中甲烷与二氧化碳体积比为
,所以理论上原料气中甲烷与二氧化碳体积比为![]() ;正确答案:3:1。
;正确答案:3:1。
(3)该反应正反应为放热反应,温度升高平衡逆向移动,CO的平衡转化率减小,所以温度由小到大的顺序为 T1<T2<T3;正确答案:T1<T2<T3 ;该正反应放热,温度升高平衡逆向移动,CO的平衡转化率减小。
(4)由于平衡常数为温度的函数,温度不变,平衡常数不变,所以平衡常数K(b)= K(d);温度高反应速率快,因为T1<T2,所以正反应速率v(a) 小于v(b);正确答案:等于; 小于。
(5)已知将1 molCO和2molH2通人密闭容器中,一氧化碳的平衡转化率为35%;计算如下:
CO(g) + 2H2(g)![]() CH3OH(g)
CH3OH(g)
起始量 1 2 0
变化量 0.35 0.7 0.35
平衡量 0.65 1.3 0.35
平衡分压 0.65/2.3 1.3/2.3 0.35/2.3
c点时反应的压强平衡常数Kp=p(CH3OH)/p(CO)p2(H2)= [0.35/2.3]/ 0.65/2.3×(1.3/2.3)2= ;正确答案:
;正确答案: 。
。
6)针对于反应CO(g +2H2(g)![]() CH3OH(g),保持温度不变,将密闭容器的容积压缩到原来的一半,相当于加压过程,平衡右移,氢气的物质的量减少,但浓度增大,所以c(H2)增大,A错误;体积变小,各物质浓度增大,正反应速率加快,逆反应速率也加快,B错误;体积缩小,压强增大,平衡右移,CH3OH的物质的量增加,C正确;将容器的容积压缩到原来的
CH3OH(g),保持温度不变,将密闭容器的容积压缩到原来的一半,相当于加压过程,平衡右移,氢气的物质的量减少,但浓度增大,所以c(H2)增大,A错误;体积变小,各物质浓度增大,正反应速率加快,逆反应速率也加快,B错误;体积缩小,压强增大,平衡右移,CH3OH的物质的量增加,C正确;将容器的容积压缩到原来的![]() ,压强增大,正、逆反应速率都增大,平衡向正反应方向移动,
,压强增大,正、逆反应速率都增大,平衡向正反应方向移动,![]() 的物质的量增加,浓度增大,氢气的物质的量减少,但浓度增大;故有
的物质的量增加,浓度增大,氢气的物质的量减少,但浓度增大;故有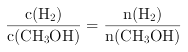 减小,D正确;平衡右移CH3OH的物质的量增加,CH3OH的体积分数增加,E正确;正确答案:CDE。
减小,D正确;平衡右移CH3OH的物质的量增加,CH3OH的体积分数增加,E正确;正确答案:CDE。
(7) 新型甲醇燃料电池,甲醇做负极发生氧化反应,电极反应式为CH3OH-6e-+302-=CO2↑+2H2O;正确答案:CH3OH-6e-+302-=CO2↑+2H2O。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案【题目】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
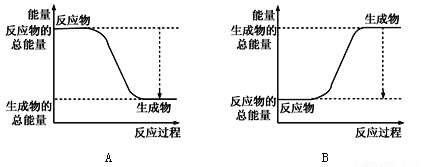
(1)已知一定条件下,反应N2+3H2![]() 2NH3为放热反应;:
2NH3为放热反应;:
①下图能正确表示该反应中能量变化的是________;
②根据下表数据,计算生成1molNH3时该反应放出的热量为______kJ;
化学键 | H-H | N≡N | N-H |
断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2 L的密闭容器中发生反应。若5min达到平衡,测得c(NH3)=0.4mol/L,则0至5min内N2的平均化学反应速率v(N2)=______,反应开始与平衡时气体的物质的量之比为__________;若达到平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0 ,请用p0、p来表示达到平衡时H2的转化率为__________。
④ 在③反应条件下,能够判断该反应已经达到化学平衡状态的是______________。
A.容器内混合气体密度不变
B.混合气体的压强不变
C.单位时间内生成n mol N2 的同时生成2n mol NH3
D. v (N2)=2v(NH3)
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:

①装置甲中SO![]() 向________ 极移动(填“A”或“B”);
向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是_____________;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g,则导线中通过电子的物质的量为______mol。
【题目】下列关于物质分类的正确组合是( )
物质分类 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | Na2CO3 | HNO3 | NaHCO3 | CaO | CO2 |
B | NaOH | HCl | NaCl | Fe3O4 | H2O2 |
C | Fe(OH)3 | HF | CaCO3 | CaO | SO2 |
D | NaOH | CH3COOH | CaF2 | K2O | CO |
A.AB.BC.CD.D