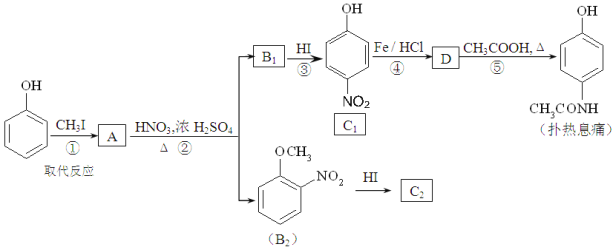
题目内容
【题目】硝酸是重要的化工原料,在工农业生产和国防上有重要用途。
(1)实验室利用硝石(NaNO3)和浓硫酸共热制取硝酸。
①该反应利用了浓硫酸的_______性;
②该反应的温度不宜太高,原因是(用化学方程式表示)______;
(2)工业上用氨气的催化氧化法制取硝酸,再利用硝酸和氨气反应生产NH4NO3。
①写出氨气的电子式_____;
②写出氨气催化氧化的化学方程式_______;
③在生产过程中,氨催化氧化生成氮氧化物的利用率是80%,氮氧化物被吸收得到硝酸的利用率是85%,则制取80 t的NH4NO3需要氨气______t;
(3)某混合酸1L中含1mol的硝酸和2mol的硫酸。取该混合酸100mL,加入5.6g铁粉充分反应。
①反应中可以生成NO____L(标准状况);
②向反应后的溶液再加入铁粉,能继续溶解铁粉____g。
【答案】高沸点性(或不挥发性) 4HNO3= 4NO2 ↑ + O2 ↑ + 2H2O ![]() 4NH3+ 5O2
4NH3+ 5O2 ![]() 4NO + 6H2O 42 2.24 5.6
4NO + 6H2O 42 2.24 5.6
【解析】
(1)利用浓硫酸的高沸点分析;
(2)根据 硝酸不稳定能分解分析;
(3)根据氨气转化为硝酸的一系列反应分析氨气的质量。
(4)注意硝酸具有强氧化性,硫酸具有酸性,同时注意铁离子能与铁反应。
(1) ①浓硫酸制取硝酸时利用浓硫酸的高沸点性(或不挥发性);
②硝酸在温度高时能分解生成二氧化氮和氧气和水,方程式为: 4HNO3= 4NO2 ↑ + O2 ↑ + 2H2O;
(2). ①氨气的电子式为:![]() ;
;
②氨气和氧气反应生成一氧化氮和水,方程式为: 4NH3+ 5O2 ![]() 4NO+ 6H2O ;
4NO+ 6H2O ;
③NH3-NO-HNO3-NH4NO3,80 t的NH4NO3需要转化为硝酸的的氨气的质量为![]() =25t,另外需要和硝酸反应的氨气的质量为
=25t,另外需要和硝酸反应的氨气的质量为![]() =17t,总共氨气的质量为25+17=42t;
=17t,总共氨气的质量为25+17=42t;
(3). ①反应的离子方程式为Fe+4H++NO3-=Fe3++NO![]() +2H2O,根据铁的物质的量为0.1mol,溶液中的氢离子为0.5mol,硝酸根离子为0.1mol分析,铁反应生成0.1mol一氧化氮,标况下的体积为 2.24L;
+2H2O,根据铁的物质的量为0.1mol,溶液中的氢离子为0.5mol,硝酸根离子为0.1mol分析,铁反应生成0.1mol一氧化氮,标况下的体积为 2.24L;
② 反应中消耗0.4mol氢离子,和0.1mol硝酸根离子,还剩余0.1mol氢离子和0.1mol铁离子,0.1mol氢离子能反应0.05mol铁,0.1mol铁离子能反应0.05mol铁,故总共反应0.1mol铁,质量为5.6g。

 夺冠金卷全能练考系列答案
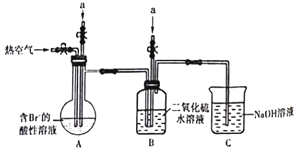
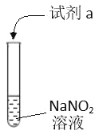
夺冠金卷全能练考系列答案【题目】利用下列实验探究亚硝酸钠(NaNO2)的化学性质(AgNO2是淡黄色难溶于水的固体)
实验 | 装置 | 试剂a | 现象 |
① |
| 酚酞 | 无色溶液变红 |
② | AgNO3溶液 | 产生淡黄色沉淀 | |
③ | 淀粉KI 溶液+稀硫酸 | 无色溶液立即变蓝 | |
④ | 酸性K2Cr2O7溶液 | 无色溶液变为绿色 |
由上述实验所得结论不正确的是
A.NaNO2溶液呈碱性:NO2-+H2OHNO2+OH-
B.NaNO2可与某些盐发生复分解反应:NO2-+Ag+=AgNO2↓
C.NaNO2有氧化性:2I-+2H++2NO2-=I2+2NO2↑+H2O
D.NaNO2有还原性:Cr2O72-+3NO2-+8H+=3NO3-+2Cr3++4H2O