题目内容
17.下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.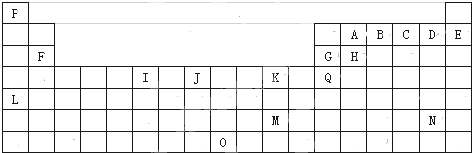
试回答下列问题:
(1)I的最高化合价为+6,K的元素名称为铜.
(2)写出基态时J元素原子的电子排布式1s22s22p63s23p63d64s2,N元素原子的简化电子排布式[Xe]4f145d106s26p5.
(3)下列对比正确的是cd.
a.原子半径H>G>B>A; b.第一电离能E>D>C>B;
c.电负性A>H>G>Q; d.最高价氧化物的水化物酸性B>A>H>G;
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是bc.
a.L位于元素周期表中第五周期、ⅠA族,属于s区元素;
b.O位于元素周期表中第七周期、ⅧB族,属于d区元素;
c.M的外围电子排布式为6s1,属于ds区元素;
d.H所在族的外围电子排布式为ns2np2,属于p区元素;
(5)由P、A、C三种元素形成的某化合物,对氢气的相对密度为15,则该分子的键角约为120°.
(6)元素B和C的气态氢化物热稳定性较强的是H2O(填化学式).
(7)K的常见离子和B的最简单氢化物形成的配离子的名称为四氨合铜离子,其水溶液颜色为深蓝色.Ag和元素K同族,且在K的下一周期,则Ag元素的原子序数为47,Ag+也可以和B的最简单氢化物形成配离子,配位数为2,请写出该配离子的符号[Ag(NH3)2]+.
分析 由元素在周期表中位置,可知P为氢、A为碳、B为氮、C为O、D为F、E为Ne、F为Mg、G为Al、H为Si、I为Cr、J为Fe、K为Cu、Q为Ga、L为Rb、N为At.
(1)I为Cr,价电子排布式为3d54s1,K为Cu;
(2)J为Fe,N为At,根据核外电子排布规律书写,简化电子排布式中用稀有气体原子符号并用[]括起代替相应内层排布;
(3)a.同周期自左而右原子半径减小、同主族自上而下原子半径增大;
b.同周期自左而右第一电离能呈增大趋势,但IIA族、VA元素的第一电离能高于同周期相邻元素的;
c.同周期自左而右电负性增大、同主族自上而下电负性减小;
d.元素非金属性越强,最高价含氧酸的酸性越强;
(4)a.由L的位置可知,L位于元素周期表中第五周期、ⅠA族,属于s区元素;
b.由O的位置可知,O位于元素周期表中第七周期Ⅷ族,属于d区元素;
c.M位于IB族,外围电子排布式为5d106s1,属于ds区元素;
d.H处于IVA族,所在族的外围电子排布式为ns2np2,属于p区元素;
(5)由H、C、O三种元素形成的某化合物,对氢气的相对密度为15,则该化合物相对分子质量为30,故该化合物为HCHO,为平面三角形;
(6)非金属性越强,对应氢化物越稳定;
(7)K的常见离子为Cu2+、B的最简单氢化物为NH3,二者形成的[Cu(NH3)4]2+配离子,其水溶液呈深蓝色,Ag和元素K同族,且在K的下一周期,二者原子序数相差为第四周期容纳元素种数;Ag+也可以和NH3形成配离子,配位数为2,该配离子为[Ag(NH3)2]+.
解答 由元素在周期表中位置,可知P为氢、A为碳、B为氮、C为O、D为F、E为Ne、F为Mg、G为Al、H为Si、I为Cr、J为Fe、K为Cu、Q为Ga、L为Rb、N为At.
(1)I为Cr,价电子排布式为3d54s1,最高正化合价为+6,K为Cu,元素名称为铜,
故答案为:+6;铜;
(2)J为Fe,原子核外有26个电子,核外电子排布式为1s22s22p63s23p63d64s2,N为At,处于第六周期VIIA,简化电子排布式为[Xe]4f145d106s26p5,
故答案为:1s22s22p63s23p63d64s2;[Xe]4f145d106s26p5;
(3)a.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径G>H>A>B,故a错误;
b.同周期自左而右第一电离能呈增大趋势,但IIA族、VA元素的第一电离能高于同周期相邻元素的,故第一电离能E>D>B>C,故b错误;
c.同周期自左而右电负性增大、同主族自上而下电负性减小,故电负性A>H>G>Q,故c正确;
d.非金属性B>A>H>G,则最高价氧化物的水化物酸性B>A>H>G,故d正确,
故选:cd;
(4)a.由L的位置可知,L位于元素周期表中第五周期ⅠA族,属于s区元素,故a正确;
b.由O的位置可知,O位于元素周期表中第七周期Ⅷ族,属于d区元素,故b错误;
c.M位于IB族,外围电子排布式为5d106s1,属于ds区元素,故c错误;
d.H处于IVA族,所在族的外围电子排布式为ns2np2,属于p区元素,故d正确,
故选:bc;
(5)由H、C、O三种元素形成的某化合物,对氢气的相对密度为15,则该化合物相对分子质量为30,故该化合物为HCHO,为平面三角形,键角约是120°,
故答案为:120°;
(6)非金属性O>N,故氢化物稳定性:H2O>NH3,
故答案为:H2O;
(7)K的常见离子为Cu2+、B的最简单氢化物为NH3,二者形成的[Cu(NH3)4]2+配离子,名称为四氨合铜离子,其水溶液呈深蓝色,Ag和元素K同族,且在K的下一周期,二者原子序数相差为第四周期容纳元素种数,故Ag的原子序数为29+18=47;Ag+也可以和NH3形成配离子,配位数为2,该配离子为[Ag(NH3)2]+.
故答案为:四氨合铜离子;深蓝色;47;[Ag(NH3)2]+.
点评 本题是对物质结构的考查,涉及元素周期表结构、核外电子排布、元素周期律、分子结构、配合物等,需要学生具备扎实的基础,难度中等.

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O且NaClO2在碱性条件下稳定性较高.试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在发生器中发生反应的化学方程式为2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O.
(2)在NaClO2稳定装置中,H2O2作B(选填序号).
A.氧化剂 B.还原剂
C.既作氧化剂又作还原剂 D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是BEA(按实验先后顺序填写操作代号).
A.过滤 B.加热蒸发 C.分液 D.蒸馏 E.冷却
(4)经查阅资料知道:当pH≤2.0时,ClO2-能被I-完全还原成Cl-;溶液中Na2S2O3能与I2反应:2Na2S2O3+I2═2NaI+Na2S4O6.欲测定成品中NaClO2的含量,现进行如下操作:
| 步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节pH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定 |
②若上述滴定操作中用去了VmL Na2S2O3溶液,则样品中NaClO2的质量分数$\frac{9.05×1{0}^{-2}VC}{4W}$×100%(用字母表示).
| A. | 碱金属元素中,金属活泼性最强的是Li | |
| B. | 第三周期元素中,原子半径最大的是Cl | |
| C. | 短周期元素最高价氧化物对应的水化物中,酸性最强的是H2SO4 | |
| D. | 原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键 |
| A. | 羰基硫中O为-2价,C、S都是+1价 | |
| B. | 羰基硫分子中共含有3个原子核、16个电子 | |
| C. | 羰基硫分子结构中只含有极性共价键 | |
| D. | 羰基硫的电子式为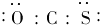 |
| A. | $\frac{M}{10s•ρ}$mol/L | B. | $\frac{1000s•ρ}{M(100+s)}$mol/L | ||
| C. | $\frac{10s•ρ}{M}$mol/L | D. | $\frac{M(100+s)}{1000s•ρ}$mol/L |
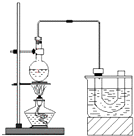 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:
实验室制备溴乙烷(C2H5Br)的装置和步骤如图: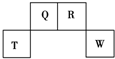 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等.请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等.请回答下列问题: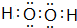 ,存在的化学键类型有非极性键和极性键.
,存在的化学键类型有非极性键和极性键.