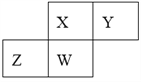
题目内容
【题目】CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1)利用CO生产乙醇: 2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g)ΔH1
CH3CH2OH(g)+H2O(g)ΔH1
又已知:H2O(l)=H2O(g)ΔH2 CO(g)+H2O(g)![]() CO2(g)+H2(g)ΔH3
CO2(g)+H2(g)ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=_______________________。
(2)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g)。下列措施中能够同时满足增大反应速率和提高CO转化率的是____(填字母)。
CH3OCH3(g)+H2O(g)。下列措施中能够同时满足增大反应速率和提高CO转化率的是____(填字母)。
A.使用高效催化剂 B.降低反应温度
C. 增大体系压强 D.不断将CH3OCH3从反应混合物中分离出来
(3)采用CO与H2反应合成再生能源甲醇,反应如下:CO(g)+ 2H2(g)![]() CH3OH(g)。在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
CH3OH(g)。在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
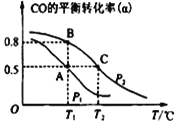
①合成甲醇的反应为_______(填 “放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为_____________。
③达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为_________L。
④CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示,实际生产时条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________。

【答案】 ΔH1 -2△H3-3△H2 C 放热 KA=KB>KC 2 250℃、1.3×104 kPa下,CO转化率已较高,再增大压强,CO的转化率提高不大,生产成本却增加
【解析】(1)已知:①2CO(g)+4H2(g)CH3CH2OH(g)+H2O(g)△H1,②H2O(1)═H2O(g)△H2,③CO(g)+H2O(g)CO2(g)+H2(g)△H3,根据盖斯定律,将①-②×3-③×2得:2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O,则:△H=△H1-3△H2-2△H3,故答案为:△H=△H1-3△H2-2△H3;
(2)A、使用高效催化剂只能增大反应速率,不能改变平衡移动,所以CO的转化率不变,故A错误;B、降低反应温度会减慢反应速率,故B错误;C、增大体系压强不仅增大反应速率,而且平衡也向正反应方向移动,所以CO的转化率也增大,故C正确;D、不断将CH3OCH3从反应混合物中分离出来,即减小生成物的浓度,则反应速率减小,故D错误;故答案为:C;
(3)①由图1可知,压强一定时,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动,即正反应为放热反应,故答案为:放热;
②平衡常数与压强无关,只与温度有关,A、B温度相等,则KA=KB,相同压强下,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动,则平衡常数减小,故KB>KC,故KA=KB>KC,故答案为:KA=KB>KC;
③A、B两点温度相等,压强不同,平衡常数相同,对应A点,CO转化率为0.5,参加反应CO为10mol×0.5=5mol,
CO(g)+2H2(g)CH3OH(g)
开始(mol):10 20 0
转化(mol):5 10 5
平衡(mol):5 10 5
故T1温度下,平衡常数K=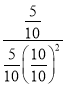 =1,对应B点,CO转化率为0.8,参加反应CO为10mol×0.8=8mol,
=1,对应B点,CO转化率为0.8,参加反应CO为10mol×0.8=8mol,
CO(g)+2H2(g)CH3OH(g)
开始(mol):10 20 0
转化(mol):8 16 8
平衡(mol):2 4 8
设平衡时的体积为VL,则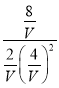 =1,解得V=2,故答案为:2;
=1,解得V=2,故答案为:2;
④由图3可知,在250°C、1.3x104kPa左右,CO的转化率已较高,再增大压强CO转化率提高不大,且增大生成成本,得不偿失,故选择250°C、1.3x104kPa左右,故答案为:在250°C、1.3x104kPa左右,CO的转化率已较高,再增大压强CO转化率提高不大,生产成本却增加。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案