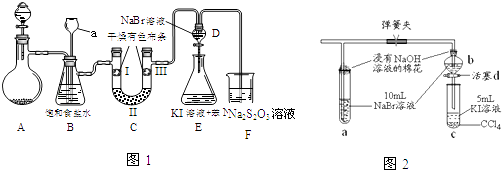
题目内容
【题目】室温下,下列溶液的离子浓度关系正确的是( )
A.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合c(Na+)+c(H+)=c(OH﹣)+c( HC2O4﹣)
B.Na2S溶液:c(Na+)>c(HS﹣)>c(OH﹣)>c(H2S)
C.NaHSO4溶液:c(H+)=c(SO ![]() )十c(OH﹣)
)十c(OH﹣)
D.pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中c(Cl﹣)>c(H+)>c(NH ![]() )>c(OH﹣)
)>c(OH﹣)
【答案】C
【解析】解:A.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合,根据电荷守恒可得:c(Na+)+c(H+)=c(OH﹣)+2c(C2O42﹣)+c(HC2O4﹣ ),故A错误;
B.Na2S溶液中,硫离子部分水解,溶液呈碱性,由于氢氧根离子来自水的电离和硫离子水解,则c(OH﹣)>c(HS﹣),溶液中正确的离子浓度大小为:c(Na+)>c(OH﹣)>c(HS﹣)>c(H2S),故B错误;
C.NaHSO4溶液中,根据电荷守恒可知:c(H+)+c(Na+)=2c(SO ![]() )+c(OH﹣),根据物料守恒c(Na+)=c(SO
)+c(OH﹣),根据物料守恒c(Na+)=c(SO ![]() )可知c(H+)=c(SO
)可知c(H+)=c(SO ![]() )+c(OH﹣),故C正确;
)+c(OH﹣),故C正确;
D.pH=12的氨水与pH=2的盐酸中,氨水浓度大于盐酸,等体积混合,氨水过量,溶液呈碱性,所以c(OH﹣)>c(H+),溶液中存在电荷守恒c(NH ![]() )+c(H+)=c(Cl﹣)+c(OH﹣),所以得c(NH
)+c(H+)=c(Cl﹣)+c(OH﹣),所以得c(NH ![]() )>c(Cl﹣),溶液中一水合氨电离程度较小,所以c(Cl﹣)>c(OH﹣),则溶液中离子浓度大小顺序是c(NH
)>c(Cl﹣),溶液中一水合氨电离程度较小,所以c(Cl﹣)>c(OH﹣),则溶液中离子浓度大小顺序是c(NH ![]() )>c(Cl﹣)>c(OH﹣)>c(H+),故D错误;
)>c(Cl﹣)>c(OH﹣)>c(H+),故D错误;
故选C.

【题目】雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一.消除氮氧化物和硫氧化物有多种方法.可用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)═N2(g)+CO2(g)△H=QkJmol﹣1 . 在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
0~10min内,CO2的平均反应速率v(CO2)= , 反应进行到30min时,NO 的转化率= .
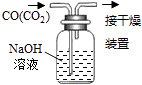
【题目】下列有关实验的选项正确的是( )
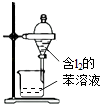
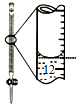
A.配制0.10molL﹣1NaOH溶液 | B.除去CO中的CO2 | C.苯萃取碘水中I2 , 分出水层后的操作 | D.记录滴定终点读数为12.20mL |
|
|
|
|
A.A
B.B
C.C
D.D