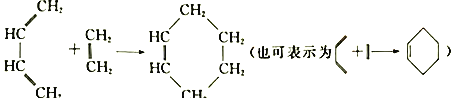
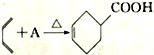
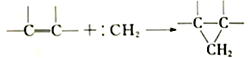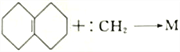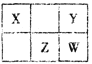题目内容
【题目】为研究卤代烃与NaOH乙醇溶液反应的情况(已知乙醇可使酸性KMnO4溶液褪色),某化学课外小组的学生进行如下实验;
(1)甲同学用图1所示装置研究CH3CH2Br与NaOH的乙醇溶液的反应,充分反应后,试管D中的现象是_________________,试管C中水的作用是_______________,实验中________(填“能”或“不 能”)用Br2的四氯化碳溶液代替酸性高锰酸钾溶液。
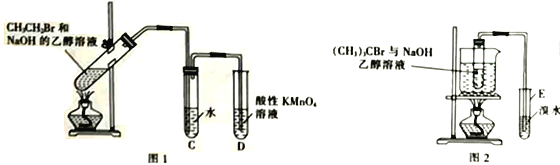
(2)乙同学用图2所示装置研究(CH3)3CBr与NaOH的乙醇溶液的反应。
①采用水浴加热的优点是_______________________________。
②发生反应后,试管E中的主要现象是_______________________________。
【答案】 酸性高锰酸钾溶液褪色 吸收挥发出来的乙醇 能 受热均匀,易控制温度 溴水褪色,溶液分层,油状物在下层
【解析】试题分析:本题为实验题,目的是研究卤代烃与NaOH乙醇溶液反应的情况。卤代烃与NaOH乙醇溶液可以发生消去反应生成不饱和烃,由于乙醇有一定的挥发性,而且乙醇、不饱和烃均能使酸性高锰酸钾溶液褪色,故在检验消去反应的产物时,要注意排除乙醇的干扰。
(1)甲同学用图1所示装置研究CH3CH2Br与NaOH的乙醇溶液的反应,充分反应后,试管D中的现象是酸性高锰酸钾溶液褪色,试管C中水的作用是吸收挥发出来的乙醇,以排除其对检验乙烯实验的干扰。由于乙醇不与Br2的四氯化碳溶液反应,故实验中能用Br2的四氯化碳溶液代替酸性高锰酸钾溶液检验乙烯。
(2)乙同学用图2所示装置研究(CH3)3CBr与NaOH的乙醇溶液的反应。
①采用水浴加热的优点是受热均匀,易控制反应温度。
②发生反应后,试管E是用于检验该反应的产物甲基丙烯,由于甲基丙烯可以与溴发生加成反应而使溴水褪色,加成产物为不溶于水、密度比水大的无色油状液体,所以其中的主要现象是溴水褪色,溶液分层,油状物在下层。

【题目】生活中有许多与化学相关的数据表格。
Ⅰ.下图是某儿童微量元素体检报告单的部分数据:某医疗机构临床检验结果报告单
分析项目 | 检测结果 | 单位 | 参考范围 | |
1 | 锌(Zn) | 115.92 | μmol/L | 66~120 |
2 | 铁(Fe) | 6.95 | mmol/L | 7.52~11.82 |
3 | 钙(Ca) | 1.68 | mmol/L | 1.55~2.10 |
…… |
根据上表的数据,回答下列问题:
(1)该儿童__________元素含量偏低。
(2)报告单中“μmol/L”是__________(填“质量”、“体积”或“浓度”)的单位。
(3)服用维生素C可使食物中的Fe3+转化为Fe2+,在这个过程中体现维生素C的__________(填“氧化性”或“还原性”)。
Ⅱ.生活中为了延长鲜花的寿命,通常会在花瓶中加入鲜花保鲜剂。下表是0.5L某种鲜花保鲜剂中含有的成分及含量,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g/mol) |
①蔗糖(C12H22O11) | 25.00 | 342 |
0.25 | 174 | |
③高锰酸钾(KMnO4) | 0.25 | 158 |
④阿司匹林(C9H8O4) | 0.17 | 180 |
⑤硝酸银(AgNO3) | 0.02 | 170 |
(4)上述鲜花保鲜剂成分中,属于盐的是__________(填序号)。
(5)欲配制500mL该鲜花保鲜剂,有如下操作步骤:
a.把称量好的保鲜剂放入小烧杯中,加适量蒸馏水溶解;
b.把a所得溶液小心转入500mL容量瓶中;
c.继续向容量瓶中加蒸馏水至液面距刻度1cm~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切;
d.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液都小心转入容量瓶,并轻轻摇匀;
e.将容量瓶塞紧,反复上下颠倒摇匀。
①操作步骤的正确顺序为(填序号)__________。
②在容量瓶的使用方法中,下列操作不正确的是__________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,需要干燥
C.盖好瓶塞,用一只手的食指顶住瓶塞,另一只手的手指托住瓶底,把容量瓶倒转和摇动几次
(6)写出该鲜花保鲜剂中K+的物质的量浓度的计算式c(K+)=__________ mol·L1。
【题目】碳、氮及其化合物与生活密切相关。请根据要求回答下列问题:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H=-l160kJ/mol
③H2O(g)= H2O(l) △H=-44kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O( 1) 的热化学方程式_________。
(2)已知: 反应I: 4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H < 0
4NO(g)+6H2O(g) △H < 0
反应II: 4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) △H < 0
2N2(g)+6H2O(g) △H < 0
①在恒温恒容装置中充入一定量的NH3 和O2,在催化剂的作用下进行反应I,则下列有关叙述中正确的是___(填字母序号)。
A.增大压强,Kp(用压强表示的化学平衡常数) 增大
B.若测得容器内3v正(NH3)=2v逆(H2O) 时,说明反应已达平衡
C.升高温度,NH3 的转化率增大
D.达到平衡时体系的压强不再变化
②氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1molNH3和2molO2,得有关物质的量关系如图,该催化剂在高温时选择反应_____(填“I”或“II”)。
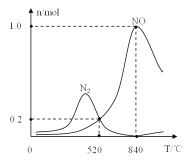
③520℃时,4NH3(g)+3O2 (g)![]() 2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式)。提高NH3转化为N2平衡转化率的措施有______( 填字母序号)
2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式)。提高NH3转化为N2平衡转化率的措施有______( 填字母序号)
A.降低反应温度 B.将反应生成的H2O(g)及时移出
C.增大NH3和O2的初始投料比 D.投料比不变,增加反应物的浓度
(3)己知25℃时HCN 和H2CO3的电离常数(Ka.)如下表:
物质 | 电离常数(Ka) |
HCN | Ka=5×10-10 |
H2CO3 | Ka1=4.5×10-7;Ka2=4.7× 10-11 |
25℃时,测得HCN 和NaCN 的混合溶液pH=11,则c(HCN)/c(CN-)=____。向NaCN 溶液中通入少量CO2,则发生反应的离子方程式为:__________。