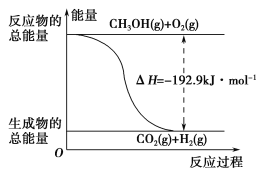
题目内容
【题目】(1)下列物质N2、H2O、Na2O2、CaCl2、KOH、NaF中,既含有离了键,又含有共价键的物质是_____,属于共价化合物的是__________。
(2)用电子式表示CaCl2的形成过程:________________。
(3)氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用产生NH3。请写出NH3的电子式是____________。
(4)Na3N与盐酸反应生成两种盐,反应的化学方程式为____________。
【答案】Na2O2、KOH H2O ![]()
![]() Na3N+4HCl==3NaCl+NH4Cl
Na3N+4HCl==3NaCl+NH4Cl
【解析】
一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键;全部由共价键形成的化合物是共价化合物。
(1)N2中只含有共价键,H2O中只含有共价键,Na2O2中既含有离子键又有共价键,CaCl2中只含有离子键,KOH中既含有离子键又有共价键,NaF中只含有离子键,因此既含有离子键,又含有共价键的物质是Na2O2、KOH,属于共价化合物的是H2O。答案:Na2O2、KOH;H2O。
(2)氯化钙是离子化合物,含有离子键,则用电子式表示CaCl2的形成过程为![]() 。答案:
。答案:![]()
(3)氮化钠(Na3N)与水作用产生NH3,,NH3的电子式是:![]() 。答案:
。答案:![]() 。
。
(4)Na3N与盐酸反应生成两种盐,根据原子守恒可知应该是氯化钠和氯化铵,因此反应的化学方程式为Na3N+4HCl=3NaCl+NH4Cl;答案:Na3N+4HCl=3NaCl+NH4Cl。

练习册系列答案
相关题目