题目内容
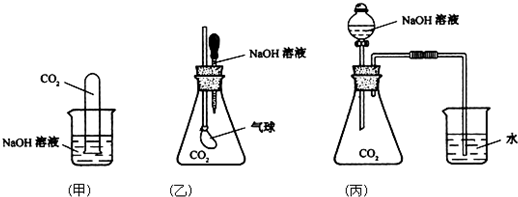
(Ⅰ)甲、乙、丙三位同学分别用如下实验装置及化学药品(碱石灰为氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答问题:
(1)甲、乙、丙三位同学制取氨气的化学方程式为:
(2)他们都用向下排空气法收集氨气,其原因是
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(实验操作都正确),你认为没有收集到氨气的同学是
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论):
(5)三位同学都认为自己的实验装置还可用于加热碳酸氢铵固体来制取纯净的氨气,你判断能够达到实验目的是
(Ⅱ)已知二氧化硫可使高锰酸钾溶液褪色.反应的化学方程式为:
5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4
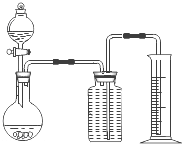
如图丁为验证浓硫酸与木炭在加热条件下,反应产物中是否含有SO2和CO2的部分装置.
(1)实验时,从
(2)可观察到A瓶的溶液
(3)C瓶溶液的作用是
分析:(I)(1)在加热条件下,氯化铵和氢氧化钙发生复分解反应生成氨气;
(2)根据气体的溶解性、密度确定收集方法;
(3)氨气能被酸吸收;
(4)氨气能使红色石蕊试纸变蓝色,也能和氯化氢反应生成氯化铵固体;
(5)碳酸氢铵分解生成氨气、水和二氧化碳,收集氨气前要除去水和二氧化碳;氯化铵受热分解生成氨气和氯化氢,温度低时,二者反应生成氯化铵;
(II)(1)洗气装置中导气管遵循“长进短出”的原则;
(2)二氧化硫具有漂白性;
(3)利用二氧化硫的漂白性检验二氧化硫.
(2)根据气体的溶解性、密度确定收集方法;
(3)氨气能被酸吸收;
(4)氨气能使红色石蕊试纸变蓝色,也能和氯化氢反应生成氯化铵固体;
(5)碳酸氢铵分解生成氨气、水和二氧化碳,收集氨气前要除去水和二氧化碳;氯化铵受热分解生成氨气和氯化氢,温度低时,二者反应生成氯化铵;
(II)(1)洗气装置中导气管遵循“长进短出”的原则;
(2)二氧化硫具有漂白性;
(3)利用二氧化硫的漂白性检验二氧化硫.
解答:解:(I)(1)在加热条件下,氯化铵和氢氧化钙反应生成氯化钙、氨气和水,反应方程式为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
(2)氨气密度小于空气且和空气不反应,所以可以采用向下排空气法收集,故答案为:NH3的密度小于空气;
(3)氨气属于碱性气体,能和酸反应,氨气通过浓硫酸时会被氧化,所以乙不能收集到氨气,故答案为:乙;
(4)氨气能使湿润的红色石蕊试纸变蓝色,也能和氯化氢反应生成氯化铵而产生白烟,其检验方法为:将湿润的红色石蕊试纸置于管口,若试纸变蓝,则说明已收集满(或用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明已收集满),
故答案为:将湿润的红色石蕊试纸置于管口,若试纸变蓝,则说明已收集满(或用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明已收集满);
(5)碳酸氢铵分解生成二氧化碳、氨气和水,要收集纯净的氨气,应除去二氧化碳和水蒸气,可以将生成的气体通过碱石灰除去二氧化碳和水蒸气,所以丙能实现;氯化铵在加热条件下分解生成氨气和氯化氢,在试管口氯化氢和氨气反应生成氯化铵固体,所以得不到氨气,故答案为:丙;不能;
(II)(1)洗气装置中导气管遵循“长进短出”的原则,所以a端气体进入进行检验,b端连接盛有澄清石灰水的实验装置用于检验是否存在CO2气体,故答案为:b;
(2)二氧化硫能使品红溶液褪色,所以将混合气体通过品红溶液时,品红溶液褪色,故答案为:褪色;
(3)C装置是检验二氧化硫是否除尽,如果还有二氧化硫则C中品红溶液褪色,故答案为:检验SO2是否除尽.
| ||
| ||
(2)氨气密度小于空气且和空气不反应,所以可以采用向下排空气法收集,故答案为:NH3的密度小于空气;
(3)氨气属于碱性气体,能和酸反应,氨气通过浓硫酸时会被氧化,所以乙不能收集到氨气,故答案为:乙;
(4)氨气能使湿润的红色石蕊试纸变蓝色,也能和氯化氢反应生成氯化铵而产生白烟,其检验方法为:将湿润的红色石蕊试纸置于管口,若试纸变蓝,则说明已收集满(或用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明已收集满),
故答案为:将湿润的红色石蕊试纸置于管口,若试纸变蓝,则说明已收集满(或用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明已收集满);
(5)碳酸氢铵分解生成二氧化碳、氨气和水,要收集纯净的氨气,应除去二氧化碳和水蒸气,可以将生成的气体通过碱石灰除去二氧化碳和水蒸气,所以丙能实现;氯化铵在加热条件下分解生成氨气和氯化氢,在试管口氯化氢和氨气反应生成氯化铵固体,所以得不到氨气,故答案为:丙;不能;
(II)(1)洗气装置中导气管遵循“长进短出”的原则,所以a端气体进入进行检验,b端连接盛有澄清石灰水的实验装置用于检验是否存在CO2气体,故答案为:b;
(2)二氧化硫能使品红溶液褪色,所以将混合气体通过品红溶液时,品红溶液褪色,故答案为:褪色;
(3)C装置是检验二氧化硫是否除尽,如果还有二氧化硫则C中品红溶液褪色,故答案为:检验SO2是否除尽.
点评:本题考查了氨气的实验室制法、收集及干燥和二氧化硫的性质,根据反应物和生成物状态确定反应装置,根据气体的溶解性及密度确定收集装置,知道氨气的检验方法,注意二氧化硫和二氧化碳都能使澄清石灰水变浑浊,要检验二氧化硫中二氧化碳时,应该先除去二氧化硫再检验二氧化碳,为易错点.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物.“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物.该药品不溶于水但能溶于人体中的胃酸.某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验: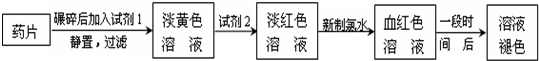
(1)试剂1是 .
(2)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是 .
(3)在实验中发现放置一段时间,溶液的颜色会逐渐褪去.为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确.写出有关的实验操作、预期现象和结论.(不一定填满,也可以补充)

(1)试剂1是
(2)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是
(3)在实验中发现放置一段时间,溶液的颜色会逐渐褪去.为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
| 编号 | 猜想 |
| 甲 | 溶液中的+3价Fe又被还原为+2价Fe |
| 乙 | 溶液中的SCN-被过量的氯水氧化 |
| 丙 | 新制的氯水具有漂白性,将该溶液漂白 |
| 编号 | 实验操作 | 预期现象和结论 |
 某课外活动小组准备用如图所示的装置进行实验.现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液:
某课外活动小组准备用如图所示的装置进行实验.现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液: