题目内容
【题目】常温下MnO2氧化浓HCl的反应方程式如下:
(1)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,则MnO2、Cl2的氧化性由强到弱的顺序是:______________________。
MnCl2+Cl2↑+2H2O,则MnO2、Cl2的氧化性由强到弱的顺序是:______________________。
(2)用“双线桥法”标明反应中电子转移的方向和数目_______________________
(3)浓盐酸在反应中显示出来的性质是________(填编号)
A只有还原性 B还原性和酸性 C只有氧化性 D氧化性和酸性
【答案】MnO2>Cl2 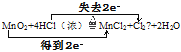 B
B
【解析】
(1)根据氧化还原反应中剂强于产物,由反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,可以知道,MnO2的氧化性强于氯气,由此分析解答;
MnCl2+Cl2↑+2H2O,可以知道,MnO2的氧化性强于氯气,由此分析解答;
(2) Mn得到2e-,Cl失去2×e-,以此用“双线桥法”标明反应中电子转移的方向和数目;
(3)浓盐酸中部分由氯是-1价,失电子,是还原剂,所以在反应中显示出来的性质是还原性和酸性。
(1)由氧化剂的氧化性大于氧化产物的氧化性可以知道,氧化性为MnO2>Cl2,
因此,本题正确答案是:MnO2>Cl2;
(2) Mn得到2e-,Cl失去2×e-,以此用“双线桥法”标明反应中电子转移的方向和数目;该反应为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,则用“双线桥法”标明反应中电子转移的方向和数目为:
MnCl2+Cl2↑+2H2O,则用“双线桥法”标明反应中电子转移的方向和数目为: ;
;
因此,本题正确答案是: ;
;
(3)浓盐酸中部分由氯是-1价,失电子,是还原剂,所以在反应中显示出来的性质是还原性和酸性,所以B选项是正确的;
因此,本题正确答案是:B。

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
