题目内容
V L Fe2(SO4)3溶液中含有a g SO42—,取此溶液0.5V L,用水稀释至2V L,则稀释后溶液中Fe3+的物质的量的浓度为

A
a g SO42—的物质的量是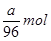 ,其浓度是
,其浓度是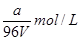 。根据化学式可知,原溶液中铁离子浓度是
。根据化学式可知,原溶液中铁离子浓度是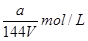 ,由于是稀释了4倍,所以稀释后铁离子的浓度是
,由于是稀释了4倍,所以稀释后铁离子的浓度是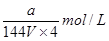 ,答案选A。
,答案选A。
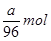 ,其浓度是
,其浓度是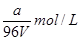 。根据化学式可知,原溶液中铁离子浓度是
。根据化学式可知,原溶液中铁离子浓度是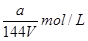 ,由于是稀释了4倍,所以稀释后铁离子的浓度是
,由于是稀释了4倍,所以稀释后铁离子的浓度是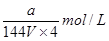 ,答案选A。
,答案选A。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
题目内容

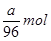 ,其浓度是
,其浓度是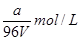 。根据化学式可知,原溶液中铁离子浓度是
。根据化学式可知,原溶液中铁离子浓度是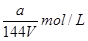 ,由于是稀释了4倍,所以稀释后铁离子的浓度是
,由于是稀释了4倍,所以稀释后铁离子的浓度是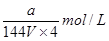 ,答案选A。
,答案选A。
 阅读快车系列答案
阅读快车系列答案