题目内容
在一定质量的氯化钡溶液中,逐滴加入密度为![]() 的硫酸溶液,当加入的
的硫酸溶液,当加入的![]() 与
与![]() 恰好完全反应时,所得溶液的质量与原氯化钡溶液的质量相等,计算该硫酸溶液的物质的量浓度.
恰好完全反应时,所得溶液的质量与原氯化钡溶液的质量相等,计算该硫酸溶液的物质的量浓度.
解析:
|
当
根据质量守恒定律,可以将上述关系进行迁移变换,得到以下关系:
这样,可以用两种不同的方法计算出加入的硫酸溶液的物质的量浓度. 解法一、(常规解法)设 根据题意: 可以得出以下等式:
二、(巧妙解法)设硫酸溶液的物质的量浓度为cmol/L,滴入硫酸溶液体积为1L. 依据: 可有: 1.45×1000=233(c×1) c=6.22(mol/L) |

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案(16分) I、实验室中常以BaSO4重量法测定BaCl2·nH2O中的Ba的含量主要步骤如下:
① 灼烧瓷坩埚至恒重,称得坩埚的质量
② 称取BaCl2·nH2O并在烧杯中溶解,加盐酸处理
③ 将一定浓度的过量硫酸滴入钡盐中得到白色沉淀
④ 静置,
⑤ 将沉淀和滤纸置于瓷坩埚中,经酒精喷灯加热碳化后,继续在800-850℃灼烧至恒重,称重
⑥ 计算
请回答下列问题:
(1)省略第①步中“灼烧瓷坩埚至恒重”可能导致计算结果_ ______(填“偏高”、“不变”或“偏低”)。
______(填“偏高”、“不变”或“偏低”)。
(2)第④步静置后的操作是 。
(3)第⑤步灼烧温度不超过900℃,是因为_______________________。
II、某同学用氨水吸收一定量的SO2,吸收后溶液中可能含有OH-、SO32-、SO42-、 HSO3- 等阴离子中的若干种。
(4)写出氨水吸收过量SO2的反应的离子方程式:
(5)已知亚硫酸氢盐一般可溶于水。仅限选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2 mol/L盐酸、2 mol/L硝酸、1 mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水。请设计实验探究吸收后溶液中是否存在SO32-、HSO3-,将实验操作、预期的实验现象和结论填在下表中。
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量待测液放入试管1中,滴加过量lmol/L氯化钡溶液。 | 若不出现浑浊,则溶液中不存在SO32-, 若出现浑浊,则溶液中可能含有SO32-。 |
| 步骤2:若出现浑浊,静置一段时间后,将上层清液倒入试管2中。往试管1中加入蒸馏水洗涤沉淀,静置后弃去上层清液,再加入 。 | |
| 步骤3: | |
(16分) I、实验室中常以BaSO4重量法测定BaCl2·nH2O中的Ba的含量主要步骤如下:
① 灼烧瓷坩埚至恒重,称得坩埚的质量
② 称取BaCl2·nH2O并在烧杯中溶解,加盐酸处理
③ 将一定浓度的过量硫酸滴入钡盐中得到白色沉淀
④ 静置,
⑤ 将沉淀和滤纸置于瓷坩埚中,经酒精喷灯加热碳化后,继续在800-850℃灼烧至恒重,称重
⑥ 计算
请回答下列问题:
(1)省略第①步中“灼烧瓷坩埚至恒重”可能导致计算结果_______(填“偏高”、“不变”或“偏低”)。
(2)第④步静置后的操作是 。
(3)第⑤步灼烧温度不超过900℃,是因为_______________________。
II、某同学用氨水吸收一定量的SO2,吸收后溶液中可能含有OH-、SO32-、SO42-、 HSO3- 等阴离子中的若干种。
(4)写出氨水吸收过量SO2的反应的离子方程式:
(5)已知亚硫酸氢盐一般可溶于水。仅限选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2 mol/L盐酸、2 mol/L硝酸、1 mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水。请设计实验探究吸收后溶液中是否存在SO32-、HSO3-,将实验操作、预期的实验现象和结论填在下表中。
|
实验操作 |
预期现象与结论 |
|
步骤1:取少量待测液放入试管1中,滴加过量lmol/L氯化钡溶液。 |
若不出现浑浊,则溶液中不存在SO32-, 若出现浑浊,则溶液中可能含有SO32-。 |
|
步骤2:若出现浑浊,静置一段时间后,将上层清液倒入试管2中。往试管1中加入蒸馏水洗涤沉淀,静置后弃去上层清液,再加入 。 |
|
|
步骤3:
|
|
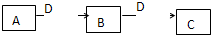 (2009?潍坊一模)A、B、C、D都是中学化学常见的物质,其中A、B、C均含同一种元素.在一定条件下相互转化关系如下图所示(部分产物已略去).请按要求回答下列问题:
(2009?潍坊一模)A、B、C、D都是中学化学常见的物质,其中A、B、C均含同一种元素.在一定条件下相互转化关系如下图所示(部分产物已略去).请按要求回答下列问题: