题目内容
【题目】实验室欲使用 500 mL 0.2 molL -1 CuSO4 溶液,配制该溶液包含以下步骤:
①称取一定质量胆矾(CuSO45H2O)、放入烧杯,用适量蒸馏水将其完全溶解;
②把溶液小心地注入容量瓶中;
③继续向容量瓶中加蒸馏水至凹液面距刻度线1~2cm 时,改用胶头滴管滴加,直到溶液的凹液面恰好与刻度线相切为止;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3 次,每次洗涤液都转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞好,充分摇匀。
请填写下列空白:
(1)应该称取胆矾的质量是_________。
(2)上述操作的正确顺序是_________。
(3)实验用到的仪器有托盘天平(砝码)、药匙、烧杯、玻璃棒__________等,玻璃棒的作用是_________。
(4)下列情况中会导致所配溶液浓度偏小的是 _________(填序号)。
a.容量瓶使用前未干燥
b.转移溶液后,烧杯没有洗涤
c.定容过程观察容量瓶内液面时,俯视刻度线
d.颠倒摇匀后,发现液面低于刻度线,不作任何处置
e.加蒸馏水时不慎超过刻度线,用胶头滴管小心地吸去超出部分,使凹液面底部与刻度线相切
(5)取 100 mL 所配溶液,向其中加入 1.68 g 铁粉,充分反应后,过滤,将固体洗涤、干燥后,再加入 1 molL-1 稀硫酸至固体不再溶解。试计算:
①至少需要稀硫酸 _________mL。
②固体溶解过程中产生氢气_________mL(标准状况)。
【答案】25 g ①②④③⑤ 500 mL 容量瓶、胶头滴管 搅拌、引流 be 10 224
【解析】
根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶以及![]() 分析解答。
分析解答。
(1)称取胆矾的质量![]() ;
;
(1)配制步骤是计算、称取一定质量胆矾(CuSO45H2O)、放入烧杯,用适量蒸馏水将其完全溶解;把溶液小心地注入容量瓶中;用少量蒸馏水洗涤烧杯和玻璃棒 2~3 次,每次洗涤液都转入容量瓶,并轻轻摇匀;继续向容量瓶中加蒸馏水至凹液面距刻度线 1~2cm 时,改用胶头滴管滴加,直到溶液的凹液面恰好与刻度线相切为止;将容量瓶塞好,充分摇匀;操作的正确顺序是①②④③⑤;
(3)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,可知所需的仪器有托盘天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管,故还缺少的玻璃仪器有:500mL容量瓶、胶头滴管;
(4)a.容量瓶不干燥,含有少量蒸馏水,对浓度无影响,故不选a;
b.没有洗涤烧杯和玻璃棒,会导致溶质的损失,则浓度偏低,故选b;
c.定容时俯视刻度线,则溶液体积偏小,浓度偏高,故不选c;
d.定容摇匀后发现溶液体积低于刻度线是正常的,不用任何操作,无影响,故不选d;
e. 加蒸馏水时不慎超过刻度线,用胶头滴管小心地吸去超出部分,会导致溶质的损失,则浓度偏低,故选e;
答案选be。
(5)1.68 g 铁粉的物质的量是![]() ,100 mL0.2 molL-1 CuSO4 溶液含CuSO4 0.02mol,根据反应方程式Fe+CuSO4=FeSO4+Cu,参加反应的铁是0.02mol,剩余的铁是0.01mol;剩余的铁粉和硫酸发生反应Fe+H2SO4=FeSO4+H2,根据方程式消耗硫酸0.01mol,生成氢气0.01mol,需要1 molL-1 稀硫酸的体积是0.01mol÷1 molL-1=0.01L=10mL;产生氢气在标准状况下的体积是0.01mol×22.4L/mol=0.224L=224 mL。
,100 mL0.2 molL-1 CuSO4 溶液含CuSO4 0.02mol,根据反应方程式Fe+CuSO4=FeSO4+Cu,参加反应的铁是0.02mol,剩余的铁是0.01mol;剩余的铁粉和硫酸发生反应Fe+H2SO4=FeSO4+H2,根据方程式消耗硫酸0.01mol,生成氢气0.01mol,需要1 molL-1 稀硫酸的体积是0.01mol÷1 molL-1=0.01L=10mL;产生氢气在标准状况下的体积是0.01mol×22.4L/mol=0.224L=224 mL。

【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9C)与Cl2 反应制备SnCl4装置如下图所示。
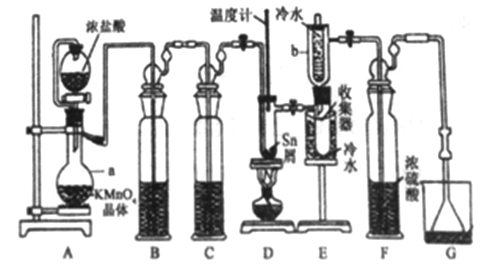
已知,① SnCl4在空气中极易水解生成SnO2xH2O;②SnCl2、SnCl4有关物理性质如下表。
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
回答下列问题:
(1)仪器a的名称是__________,其中发生反应的离子方程式为________。
(2)装置B、C 中盛装的试剂分别是_______、__________。
(3)当观察到装置F液面上方出现_____现象时才开始点燃酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的有:①加快氯气与锡反应,②__________。
(4)E装置中b的作用是___________。
(5)若制得产品中含有少量Cl2,则可采用下列_____(填字母)措施加以除去。
A.加入NaOH 萃取分液 B.加入足量锡再加热蒸馏
C.加入碘化钾冷凝过滤 D.加入饱和食盐水萃取
(6)可用滴定法测定最后产品的纯度。准确称取该样品mg加入到适量浓盐酸溶解,然后再加水稀释至250 mL,用移液管移取25.00 ml,稀释后的溶液于锥形瓶中,加入两滴淀粉溶液作指示制,用cmol/L 的KIO3 标准溶液进行滴定,平行滴定3 次,平均消耗V mL的标准溶液。已知滴定时发生的反应为:Sn2++IO3-+H+→Sn4++I2+H2O(未配平)。回答下列问题:
①判断达到滴定终点的现象为____________。
②产品中SnCl2(摩尔质量为M g/mol )的含量为____%(用含m、c、V、M 的代数式表示)。