题目内容
向体积均为10 mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液
甲和乙;向甲、乙两溶液中分别滴加0.1mol·L-1盐酸,此时反应生成CO2体积(标准状况) 与所加盐酸体积间的关系如图所示。则下列叙述中正确的是( )
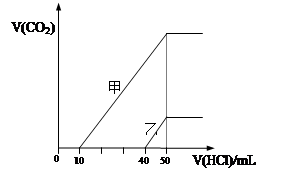
甲和乙;向甲、乙两溶液中分别滴加0.1mol·L-1盐酸,此时反应生成CO2体积(标准状况) 与所加盐酸体积间的关系如图所示。则下列叙述中正确的是( )
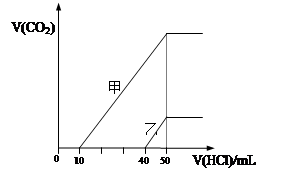
| A.原NaOH溶液的物质的量浓度为0.5 mol·L-1 |
| B.当0<V(HCl)<10mL时,甲溶液中发生反应的离子方程式为: OH-+H+=H2O |
| C.乙溶液中含有的溶质是NaOH、NaHCO3 |
| D.乙溶液中滴加盐酸后产生CO2体积的最大值为112mL(标准状况) |
A
试题分析:A、HCl加入50ml时,恰好反应生成NaCl,根据Na元素和Cl元素守恒,HCl的物质的量等于NaOH的物质的量,所以c(NaOH)=0.05L×0.1mol/L÷0.01L=0.5mol?L?1,正确;B、根据甲的图像可知,甲溶液含有Na2CO3和NaHCO3,所以0<V(HCl)<10mL时,甲溶液中发生反应的离子方程式为:CO32?+H++=HCO3?,错误;C、根据乙的图像可知,乙溶液含有NaOH和Na2CO3,错误;D、当乙溶液加入的HCl体积 40<V(HCl)<50mL时,发生反应:HCO3?+H+=CO2↑+H2O,V(CO2)=0.01L×0.1mol/L×22.4L/mol=0.0224L=22.4mL,错误。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
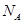 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是