题目内容
【题目】CO2(g)与H2S(g)在高温的反应为CO2(g)+H2S(g)![]() COS(g)+H2O(g),在620K时将0.1mol的CO2(g)与0.4molH2S加入体积为2.5L的空钢瓶中,平衡后H2O(g)的体积分数为0.03,将温度降至610K重复上述实验,平衡后H2O(g)的体积分数为0.02。
COS(g)+H2O(g),在620K时将0.1mol的CO2(g)与0.4molH2S加入体积为2.5L的空钢瓶中,平衡后H2O(g)的体积分数为0.03,将温度降至610K重复上述实验,平衡后H2O(g)的体积分数为0.02。
(1)下列可判断反应达到平衡的是_____________。
a.v正(H2S)=v正(COS) b.容器内压强不再变化
c.c(H2S)/c(COS)不再变化 d. v正(H2S)=v逆(COS)
(2)620K时H2S的平衡转化率a=_______%,该反应的平衡常数表达式为K=____________;
(3)该反应的ΔH _____0。(填“>”、“<”或“=”)。
(4)一定可以提高平衡体系中H2O的体积分数,又能加快反应速率的措施是_____________。
a.减少COS的浓度 b.增大H2S浓度 c.加入催化剂 d.增大压强 e.升温
(5)610K时平衡后,t时刻往钢瓶中充入不参与反应的气体并保持压强不变而使体积加倍,请画出从t时刻后一段时间内的速率时间图像。_______________

【答案】 cd 3.75 ![]() > e
> e 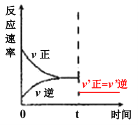
【解析】(1)a项,v正(H2S)=v正(COS),逆反应速率未知,不知道正逆反应速率是否相等,不能判断反应是否达到平衡,故a错误;b项,该反应在恒容容器中进行,且为气体分子数不变的反应,所以容器内压强始终不变,不能通过压强判断反应是否达到平衡,故b错误;该反应只要没有达到平衡,反应物和生成物的浓度就会发生变化,c(H2S)/c(COS)就会变化,当c(H2S)/c(COS)不再变化时说明反应已经达到平衡,故c正确;d项,用不同物质表示的速率数值之比等化学计量数之比,所以v正(H2S)=v正(COS),又因为v正(H2S)=v逆(COS),所以正(COS)=v逆(COS),反应达到平衡,故d正确。
(2)由化学方程式可得,该反应气体的物质的量不变,在620K时将0.1mol的CO2(g)与0.4molH2S加入体积为2.5L的空钢瓶中,H2S的平衡转化率为a,则平衡后反应的H2S为0.4a,生成的H2O(g)为0.4a,气体总物质的量仍为0.1mol+0.4mol=0.5mol,因为平衡后H2O(g)的体积分数为0.03(体积分数等于物质的量分数),所以0.4a÷0.5=0.03,解得:a=0.0375=3.75%。因为化学平衡常数表示各生成物浓度的化学计量数次幂的乘积与各反应物浓度的化学计量数次幂的乘积的比值,所以该反应的平衡常数表达式为K=![]() 。
。
(3)因为将温度降至610K重复上述实验,平衡后H2O(g)的体积分数为0.02<0.03,所以降温不利于平衡正向移动,故该反应的正向为吸热反应,ΔH>0。
(4)a.减少COS的浓度,平衡右移,能提高H2O的体积分数,但反应速率减慢,故a错误;b.增大H2S浓度,化学反应速率加快,平衡右移,H2O的物质的量增大,但总物质的量也增大,因此不一定能提高平衡体系中H2O的体积分数,故b错误;c.加入催化剂能加快反应速率,但平衡不移动,不能提高平衡体系中H2O的体积分数,故c错误;d.增大压强,不一定能提高平衡体系中H2O的体积分数,也不一定能加快反应速率,例如:充入稀有气体使压强增大,不改变反应速率和化学平衡状态,故d错误;e.升温,化学反应速率加快,因为该反应正向吸热,所以平衡正向移动,提高了平衡体系中H2O的体积分数,故e正确。
(5)由化学方程式可得,该反应气体分子数不变,充入不参与反应的气体并保持压强不变而使体积加倍,则化学反应速率减慢,平衡不移动,因此速率时间图像为: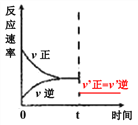 。
。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
