题目内容
【题目】元素及其化合物在化工、医药、材料等领域有着广泛的应用,回答下列问题:
(1)参照下图B、F元素的位置,依据第二周期元素第一电离能的变化规律,用小黑点标出C、N、O三种元素的相对位置。_________
(2)碳的一种单质的结构如图(a)所示,则碳原子的杂化轨道类型为__________________。
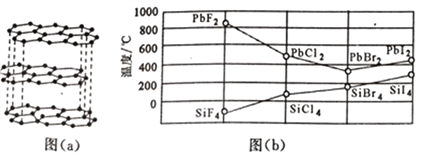
(3)二卤化铅PbX2的熔点如图(b)所示,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性__________(填“增强”、“ 不变”或“减弱”,下同),共价性__________。
(4)NH3和F2在Cu催化下可发生反应4NH3+3F2![]() NF3+3NH4F,化学方程式中的5种物质所属的晶体类型有_____(填序号)。写出基态铜原子的价电子排布式_____________。
NF3+3NH4F,化学方程式中的5种物质所属的晶体类型有_____(填序号)。写出基态铜原子的价电子排布式_____________。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
(5)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
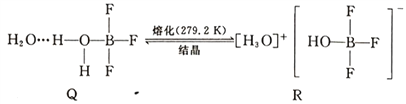
晶体R中含有的化学键包括____________。
(6)水杨酸第一级电离形成离子![]() ,相同温度下,水杨酸的Ka2_________苯酚(
,相同温度下,水杨酸的Ka2_________苯酚(![]() )的Ka(填“>”“ =”或“<”),其原因是_______________。
)的Ka(填“>”“ =”或“<”),其原因是_______________。
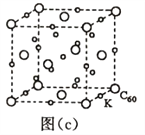
(7)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示,K位于立方体的棱上和立方体的内部,此化合物的化学式为_____________;其晶胞参数为1.4nm,阿伏加德罗常数用NA表示,则晶体的密度为_________g·cm-3。(只需列出式子)
【答案】  sp2 减弱 增强 abd 3d104s1 离子键、共价键、配位键 <
sp2 减弱 增强 abd 3d104s1 离子键、共价键、配位键 < ![]() 中形成分子内氢键,使其更难电离出H+ K3C60
中形成分子内氢键,使其更难电离出H+ K3C60 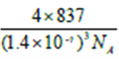
【解析】试题分析:本题考查第一电离能的比较、价电子排布式的书写、杂化方式的判断、熔点高低的比较、晶体类型和化学键的判断、氢键对物质性质的影响、晶胞的分析和计算。
(1)根据同周期从左到右元素的第一电离能呈增大趋势,N的价电子排布式为2s22p3,处于半满较稳定,第一电离能:B![]() C
C![]() O
O![]() N
N![]() F,答案为:
F,答案为: 。
。
(2)该单质为石墨,石墨属于混合型晶体,根据图a,每个碳原子形成3个σ键,碳原子上没有孤电子对,碳原子的杂化轨道类型为sp2杂化。
(3)由图b可见,PbX2的熔点依F、Cl、Br、I的顺序先减小后增大,且PbF2的熔点最高;同主族从上到下元素的非金属性减弱,说明依F、Cl、Br、I的顺序,PbX2中的化学键的离子性减弱,共价性增强。
(4)NH3、F2、NF3属于分子晶体,Cu属于金属晶体,NH4F属于离子晶体,答案选abd。Cu原子核外有29个电子,基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,基态Cu原子的价电子排布式为3d104s1。
(5)根据R的结构,R中阴、阳离子间为离子键,H3O+、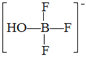 中都存在共价键和配位键,晶体R中含有的化学键为离子键、共价键、配位键。
中都存在共价键和配位键,晶体R中含有的化学键为离子键、共价键、配位键。
(6)![]() 中可形成分子内氢键,使其更难电离出H+,所以相同温度下,水杨酸的Ka2
中可形成分子内氢键,使其更难电离出H+,所以相同温度下,水杨酸的Ka2![]() 苯酚的Ka。
苯酚的Ka。
(7)用“均摊法”,1个晶胞中含K:12![]() +9=12,C60:8
+9=12,C60:8![]() +6
+6![]() =4,K与C60的个数比为12:4=3:1,此化合物的化学式为K3C60。1个晶胞的体积为(1.4nm)3=1.43
=4,K与C60的个数比为12:4=3:1,此化合物的化学式为K3C60。1个晶胞的体积为(1.4nm)3=1.43![]() 10-21cm3,1mol晶体的体积为1.43
10-21cm3,1mol晶体的体积为1.43![]() 10-21
10-21![]() 4
4![]() NA cm3,1mol晶体的质量为837g,晶体的密度为837g
NA cm3,1mol晶体的质量为837g,晶体的密度为837g![]() (1.43
(1.43![]() 10-21
10-21![]() 4
4![]() NA cm3)=
NA cm3)=![]() g/cm3。
g/cm3。

【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)请写出H2SO3的电离平衡常数K1的表达式:________________。
(2) 常温下,将体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
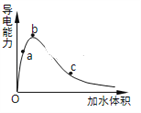
(3)一定条件下,冰醋酸加水稀释过程中溶液导电能力I随加水体积V变化曲线如右图所示,则a、b、c三点溶液醋酸的电离程度由大到小为____________________。
(4)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为___________。
(5)体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(6)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为________________。
【题目】(1)某化学兴趣小组利用下列试剂:铁粉、锌粉、0.1 mol·L1 FeCl3溶液、0.1 mol·L1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
①用所给试剂写出体现Fe2+具有还原性的反应的化学方程式:_________________________________。
②设计实验方案,完成下列表格。
探究内容 | 实验方案 | 实验现象 |
探究Fe3+具有氧化性 | 取少量0.1 mol·L1 FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液 | 加入铁粉后,溶液颜色变为________。加入KSCN溶液后,溶液________ |
③该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为_________________________________________。
(2)某反应中反应物与生成物有Fe3+、Mn2+、H+、![]() 、H2O和一种未知离子X,已知
、H2O和一种未知离子X,已知![]() 在反应中得到电子,则X离子是____________,该反应的离子方程式是____________________________。
在反应中得到电子,则X离子是____________,该反应的离子方程式是____________________________。
(3)有一铁的氧化物样品,用5 mol·L1的盐酸140 mL恰好完全溶解,所得溶液还能与通入的0.56 L氯气(标准状况)反应,使Fe2+全部转化为Fe3+,则此氧化物为________。