题目内容
【题目】A、B、C、D、E都为短周期元素,A原子失去一个电子后成为一个质子;C的-1价阴离子与氖原子具有相同的电子层结构;D在C的下一周期,D可与同周期的B形成BD2型离子化含物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题。
(1)B元素在元素周期表中的位置是____________。
(2)画出D元素的原子结构示意图____________。
(3)A与E形成的最简单化合物的电子式为____________。
(4)C的氢化物与D的氢化物的沸点相比较:____________(用化学式表示,且用>符号连接)。
(5)E的最高价氧化物对应的水化物的稀溶液与过量铁粉发生反应的离子方程式为____________。
【答案】(1)第三周期ⅡA族;
(2) ;(3)
;(3)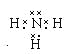 ;(4)HF>HCl;
;(4)HF>HCl;
(5)3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
【解析】试题分析:A、B、C、D、E都为短周期元素,A原子失去一个电子后成为一个质子,则A是H元素;C的-1价阴离子与氖原子具有相同的电子层结构,则C是F元素;D在C的下一周期,D可与同周期的B形成BD2型离子化含物,则B是Mg元素,D是Cl元素;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸,则E是N元素。(1)B元素是Mg,在元素周期表中的位置是第三周期ⅡA族;(2) D元素是Cl,其原子结构示意图是 ;(3)A与E形成的最简单化合物NH3的电子式为
;(3)A与E形成的最简单化合物NH3的电子式为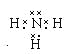 ;(4)元素的非金属性:F>Cl。原子半径F<Cl,所以在HF分子之间存在氢键,增加了分子之间的吸引力,所以物质的熔沸点比HCl高。故元素的C的氢化物与D的氢化物的沸点相比较,HF>HCl;(5)E的最高价氧化物对应的水化物HNO3的稀溶液具有强的氧化性,与过量铁粉发生反应,产生Fe2+、NO和水,根据原子守恒、电子守恒及电荷守恒,可得反应的离子方程式为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O。
;(4)元素的非金属性:F>Cl。原子半径F<Cl,所以在HF分子之间存在氢键,增加了分子之间的吸引力,所以物质的熔沸点比HCl高。故元素的C的氢化物与D的氢化物的沸点相比较,HF>HCl;(5)E的最高价氧化物对应的水化物HNO3的稀溶液具有强的氧化性,与过量铁粉发生反应,产生Fe2+、NO和水,根据原子守恒、电子守恒及电荷守恒,可得反应的离子方程式为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O。

 习题精选系列答案
习题精选系列答案