题目内容
下列叙述不正确的是( )
| A.化学平衡发生移动,平衡常数不一定发生变化 |
| B.升高温度会增大化学反应速率,其原因是增大了活化分子的百分数 |
C.某化学反应的能量变化如图所示,则该反应的ΔH>0,ΔS>0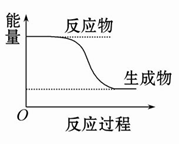 |
D.H3PO4的电离常数: 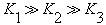 |
C
解析

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列反应一定属于放热反应的是( )。
| A.氢氧化钡晶体和氯化铵晶体的反应 |
B.能量变化如图所示的反应 |
| C.化学键断裂吸收的能量比化学键形成放出的能量少的反应 |
| D.不需要加热就能发生的反应 |
能源是当今社会发展的三大支柱之一。有专家提出:如果能够利用太阳能使燃料燃烧产物(如CO2、H2O、N2等)重新组合(如下图),可以节约燃料,缓解能源危机。在此构想的物质循环中太阳能最终转化为( )
| A.化学能 | B.热能 | C.生物能 | D.电能 |
已知:①2H2(g)+O2(g) 2H2O(g)ΔH="-483.6" kJ/mol
2H2O(g)ΔH="-483.6" kJ/mol
②H2(g)+S(g)=H2S(g) ΔH="-20.1" kJ/mol。下列判断正确的是( )
| A.1 mol氢气完全燃烧吸热241.8 kJ |
| B.1 mol H2O(g)和1 mol H2S(g)的能量相差221.7 kJ |
| C.由①②知,水的热稳定性小于硫化氢 |
| D.若反应②中改用固态硫,1 mol S(s)完全反应,放出的热量小于20.1 kJ |
下列与化学反应能量变化相关的叙述正确的是 ( )。
| A.生成物总能量一定低于反应物总能量 |
| B.酒精可用作燃料,说明酒精燃烧是释放能量的反应 |
| C.干冰气化需要吸收大量的热,这个变化是吸热反应 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
已知:
S(s)+O2(g) SO2(g) ΔH=-297.16 kJ·mol-1,
SO2(g) ΔH=-297.16 kJ·mol-1,
2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1。
2SO3(g) ΔH=-196.6 kJ·mol-1。
下列说法正确的是 ( )
| A.1 mol SO2(g)的能量总和大于1 mol S(s)和1 mol O2(g)的能量总和 |
| B.将2 mol SO2(g)与1 mol O2(g)在一定条件下充分反应,放出196.6 kJ的热量 |
| C.S(g)+O2(g)=SO2(g) ΔH=-Q,Q值小于297.16 kJ |
| D.当1 mol S(s)完全转化为SO3(g)时(假设无热量损失),放出395.46 kJ的热量 |
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%。下列热化学方程式正确的是 ( )。
A.2SO3(g)  2SO2(g)+O2(g)ΔH=+196.6 kJ·mol-1 2SO2(g)+O2(g)ΔH=+196.6 kJ·mol-1 |
B.2SO2(g)+O2(g)  SO3(g)ΔH=-98.3 kJ·mol-1 SO3(g)ΔH=-98.3 kJ·mol-1 |
C.SO2(g)+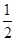 O2(g) O2(g) SO3(g)ΔH=+98.3 kJ·mol-1 SO3(g)ΔH=+98.3 kJ·mol-1 |
D.SO2(g)+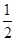 O2(g) O2(g) SO3(g)ΔH=-196.6 kJ·mol-1 SO3(g)ΔH=-196.6 kJ·mol-1 |
在同温同压下,下列各组热化学方程式中ΔH1>ΔH2的是( )。
| A.2H2(g)+O2(g)=2H2O(l) ΔH1 2H2(g)+O2(g)=2H2O(g) ΔH2 |
| B.S(g)+O2(g)=2SO2(g) ΔH1S(s)+O2(g)=2SO2(g) ΔH2 |
C.C(s)+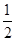 O2(g)=CO(g) ΔH1 C(s)+O2(g)=CO2(g) ΔH2 O2(g)=CO(g) ΔH1 C(s)+O2(g)=CO2(g) ΔH2 |
D.H2(g)+Cl2(g)=2HCl(g) ΔH1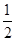 H2(g)+ H2(g)+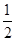 Cl2(g)=HCl(g) ΔH2 Cl2(g)=HCl(g) ΔH2 |
下列与化学反应能量变化相关的叙述正确的是 ( )。
| A.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| B.1 mol S完全燃烧放热297.3 kJ,其热化学方程式:S+O2=SO2 ΔH=-297.3 kJ·mol-1 |
| C.1 mol H2SO4与1 mol Ba(OH)2反应生成1 mol BaSO4沉淀时放出的热量叫做中和热 |
| D.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |