题目内容
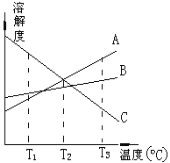
【题目】室温下向10mL0.1mol/LNaOH溶液中加入0.1mol/L的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是( )

A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A—)+c(HA)
D.b点所示溶液中c(A—)>c(HA)
【答案】D
【解析】
试题分析:A.a点时二者恰好完全反应,得到NaA,由于溶液的pH=8.7,显碱性,说明该盐是强碱弱酸盐,HA是弱酸,在溶液中A-发生水解反应:A-+H2O![]() HA+OH-,当最终达到平衡时,溶液中c(OH-)>c(H+),但是溶液中水解产生的HA的浓度大于水电离产生的氢离子的浓度,c(HA)>c(H+),A错误;B.a点A- 水解,促进水的电离,b点时HA过量,溶液呈酸性,HA电离出H+ ,抑制水的电离,因此二者中水的电离程度不相同,B错误;C.根据电荷守恒可得:c(H+)+ c(Na+)=c(A—)+c(OH-),由于pH=7,所以c(H+)= c(H+),故溶液中c(Na+)= c(A—),C错误;D.b点HA过量一倍,溶液存在NaA和HA,溶液呈酸性,说明HA程度大于A- 水解程度,则存在c(A-)>c(HA),D正确,答案选D。
HA+OH-,当最终达到平衡时,溶液中c(OH-)>c(H+),但是溶液中水解产生的HA的浓度大于水电离产生的氢离子的浓度,c(HA)>c(H+),A错误;B.a点A- 水解,促进水的电离,b点时HA过量,溶液呈酸性,HA电离出H+ ,抑制水的电离,因此二者中水的电离程度不相同,B错误;C.根据电荷守恒可得:c(H+)+ c(Na+)=c(A—)+c(OH-),由于pH=7,所以c(H+)= c(H+),故溶液中c(Na+)= c(A—),C错误;D.b点HA过量一倍,溶液存在NaA和HA,溶液呈酸性,说明HA程度大于A- 水解程度,则存在c(A-)>c(HA),D正确,答案选D。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH2 II
CO(g)+H2O(g)ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)![]() H2O(g)ΔH3= + 44.0kJ·mol-1
H2O(g)ΔH3= + 44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的逆反应平衡常数表达式K= ;反应II的ΔH2= kJ·mol-1。
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有 。
A.使用催化剂Cat.1 B.使用催化剂Cat.2 C.降低反应温度
D.增大CO2和H2的初始投料比 E.投料比不变,增加反应物的浓度
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是 。
(4)在图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图。