题目内容
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是()
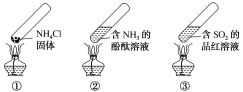
A.加热时,①中上部汇集了NH4Cl固体
B.加热时,②中溶液变红,冷却后又都变为无色
C.加热时,③中溶液变红,冷却后红色褪去,体现SO2的氧化性
D.三个“封管实验”中所发生的化学反应都是可逆反应
【答案】A
【解析】
A. 加热时,①上部汇集了固体NH4Cl,是由于氯化铵不稳定,受热易分解成氨气和氯化氢,分解生成的氨气和氯化氢遇冷重新反应生成氯化铵,A项正确;
B. 加热时氨气逸出,②中颜色为无色,冷却后氨气又溶解②中为红色,B项错误;
C. 二氧化硫与有机色素化合生成无色物质而具有漂白性,受热又分解,恢复颜色,体现SO2的漂白性,C项错误;
D. ①中氯化铵受热分成氨气和氯化氢、氨气与氯化氢化合成氯化铵的反应不是可逆反应,D项错误;
答案选A。

练习册系列答案
相关题目
【题目】下面是元素周期表的结构,用化学用语完成下列问题。
① | |||||||||||||||||
② | ③ | ④ | |||||||||||||||
⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||||||||||||
(1)表中有编号的元素中化学性质最不活泼的,其原子结构示意图为__;④与⑤按照原子个数比1∶1形成的化合物中含有的化学键有___。
(2)①与②形成的最简单化合物的空间构型为__,将此化合物与⑧的单质混合于一干燥的集气瓶,密封后放在光亮处一段时间后,观察到的现象是__。
(3)由③形成的单质的电子式为__;⑤与⑦的最低价形成的化合物的电子式为__。
(4)⑧的最高价氧化物对应的水化物的化学式是___;①分别与④、⑦形成的简单化合物的稳定性由强到弱的顺序是__。
(5)④、⑥、⑧三种元素的原子形成的简单离子中半径由大到小的顺序是__。
(6)运用你掌握的化学理论,设计一个实验,证明⑦的非金属性比②强__(用化学方程式表示出反应原理)。


