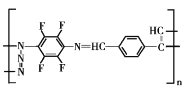
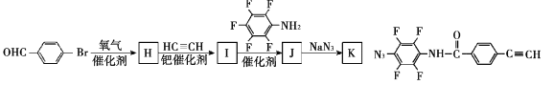
题目内容
【题目】通常状况下,稀强酸、稀强碱反应生成1mol水时放出![]() 的热
的热
(1)实验室中可用稀盐酸和氢氧化钡稀溶液反应来测定中和热。请写出能表示该反应中和热的热化学方程式 ______ ;
(2)分别取100mL![]() 盐酸与100mL
盐酸与100mL![]() NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。假设盐酸和氢氧化钠溶液的密度都是
NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。假设盐酸和氢氧化钠溶液的密度都是![]() ,中和后生成溶液的比热容
,中和后生成溶液的比热容![]() 实验时,测得反应前盐酸与NaOH溶液的平均温度为
实验时,测得反应前盐酸与NaOH溶液的平均温度为![]() ,反应后混合溶液的温度为
,反应后混合溶液的温度为![]() 则实验测得的中和热
则实验测得的中和热![]() ______
______ ![]() 保留1位小数
保留1位小数![]()
【答案】![]()
![]()
【解析】
(1)根据酸碱中和反应生成1mol液态水时放出57.3kJ的热量书写热化学方程式;
(2)根据Q=mc△T计算;
(1)已知稀强酸、稀强碱反应生成1mol液态水时放出![]() 的热量,稀盐酸和氢氧化钡稀溶液都是强酸和强碱的稀溶液,则反应的热化学方程式为
的热量,稀盐酸和氢氧化钡稀溶液都是强酸和强碱的稀溶液,则反应的热化学方程式为![]() ,
,
故答案为:![]() ;
;
(2)![]()
![]() 盐酸与100mL
盐酸与100mL![]() NaOH溶液进行中和反应生成水的物质的量为
NaOH溶液进行中和反应生成水的物质的量为![]() , 溶液的质量为:
, 溶液的质量为:![]() ,温度变化的值为
,温度变化的值为![]() ,
,
则生成![]() 水放出的热量为
水放出的热量为![]() ,即
,即![]() ,
,
所以实验测得的中和热![]() ,
,
故答案为:![]() ;
;

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】Ⅰ.实验室制得气体中常含有杂质,影响其性质的检验。下图A为除杂装置,B为性质检验装置,完成下列表格:
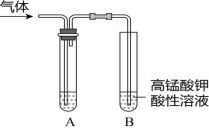
序号 | 气体 | 反应原理 | A中试剂 |
① | 乙烯 | 无水乙醇与浓硫酸共热,反应的化学方程式是______ | ___ |
② | 乙烯 | 溴乙烷与NaOH的乙醇溶液共热,反应的化学方程式是_____ | ___ |
③ | 乙炔 | 向电石中滴加饱和食盐水,反应的化学方程式是___ | ____ |
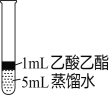
Ⅱ.为探究乙酸乙酯的水解情况,某同学取大小相同的3支试管,分别加入以下溶液,充分振荡,放在同一水浴中加热相同时间,观察到如下现象。
试管编号 | ① | ② | ③ |
实验操作 |
|
|
|
实验现象 | 酯层变薄 | 酯层消失 | 酯层基本不变 |
(1)试管②中反应的化学方程式是__________。
(2)设计试管③实验的作用是/span>__________。
(3)实验结论是__________。