题目内容
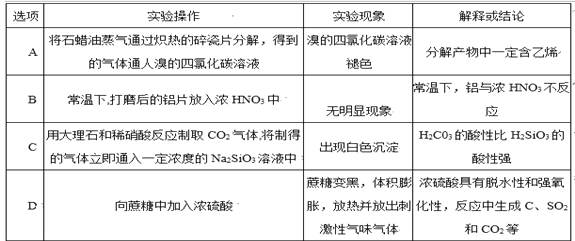
【题目】下列叙述正确的是 ( )
A. 固体SiO2一定是晶体
B. 晶体有固定的组成,非晶体没有固定的组成
C. 晶体内部的微粒按一定规律呈周期性有序排列
D. 冰和固体碘晶体中相互作用力相同
【答案】C
【解析】从晶体与非晶体的本质差异上来判断。固体SiO2有晶体和无定形两类,A项错误;非晶体如玻璃同样有固定的组成,B项错误;晶体的特殊性质都是其内部微粒按一定规律周期性排列的结果,C项正确;冰中微粒间的作用力除范德华力外还存在氢键,而碘晶体微粒间仅存在范德华力,D项错误。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目