题目内容
甲、乙两烧杯中各有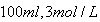 的盐酸和
的盐酸和 溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为( )
溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为( )
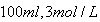 的盐酸和
的盐酸和 溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为( )
溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为( )| A.5.4g | B.3.6 g | C.2.7 g | D.1.8 g |
A
由铝与酸碱反应的方程式:
2Al+6H+=2Al3++3H2↑ 2Al+2OH-+2H2O=2AlO2-+3H2↑
当铝均不足时,所得气体的体积比为1:1,而当铝均过量时,所得气体的体积比为1:3,故可判定在与酸反应时铝过量:得出所得氢气为0.15mol,从而可知铝与碱反应所得氢气为0.3mol;
而与碱反应时铝不足:由氢气的量可计算出铝的量为0.2mol,也就是5.4g
2Al+6H+=2Al3++3H2↑ 2Al+2OH-+2H2O=2AlO2-+3H2↑
当铝均不足时,所得气体的体积比为1:1,而当铝均过量时,所得气体的体积比为1:3,故可判定在与酸反应时铝过量:得出所得氢气为0.15mol,从而可知铝与碱反应所得氢气为0.3mol;
而与碱反应时铝不足:由氢气的量可计算出铝的量为0.2mol,也就是5.4g

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
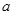 g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为
g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为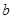 L。反应的化学方程式是_________________。样品中铝的质量是____________g。
L。反应的化学方程式是_________________。样品中铝的质量是____________g。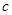 L,该气体与(1)中所得气体的体积比
L,该气体与(1)中所得气体的体积比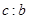 =_________。
=_________。