题目内容
在保持平衡的天平的左右两盘中各放一只大小和质量均相同的烧杯,两烧杯中都盛有1mol/L的稀硫酸100mL,然后分别向两烧杯中加入一定质量的金属,充分反应后天平仍保持平衡,则金属的质量分别是( )
分析:分别向两烧杯中加入一定质量的金属,充分反应后天平仍保持平衡,说明加入的金属的质量与生成氢气的质量之差相同,可利用差量法解答该题.
解答:解:n(H2SO4)=0.1mol,相关方程式有:2Na+H2SO4=Na2SO4+H2↑、Mg+H2SO4=MgSO4+H2↑、2Al+3H2SO4=Al2(SO4)3+3H2↑,
A.n(Na)=
=0.2mol,生成氢气0.1mol,质量为0.2g,烧杯增重4.6g-0.2g=4.4g,n(Mg)=
=0.2mol,由于硫酸不足,则生成氢气0.1mol,质量为0.2g,烧杯增重4.8g-0.2g=4.6g,天平不平衡,故A错误;
B.n(Na)=
mol,生成氢气质量为
g,烧杯增重5g-
g,n(Al)=
mol,硫酸不足,生成氢气0.2g,烧杯增重5g-0.2g=4.8g,天平不平衡,故B错误;
C.n(Na)=
=0.1mol,生成氢气0.05mol,质量为0.1g,烧杯增重2.3g-0.1g=2.2g,n(Mg)=
=0.1mol,生成氢气0.1mol,质量为0.2g,烧杯增重2.4g-0.2g=2.2g,充分反应后天平仍保持平衡,故C正确;
D.n(Al)=
=
mol,生成氢气0.1mol,质量为0.2g,烧杯增重1.8g-0,2g=1.6g,n(Mg)=
=0.1mol,生成氢气0.1mol,质量为0.2g,烧杯增重2.4g-0.2g=2.2g,天平不平衡,故D错误.
故选C.
A.n(Na)=
| 4.6g |
| 23g/mol |
| 4.8g |
| 24g/mol |
B.n(Na)=
| 5 |
| 23 |
| 5 |
| 23 |
| 5 |
| 23 |
| 5 |
| 27 |
C.n(Na)=
| 2.3g |
| 23g/mol |
| 2.4g |
| 24g/mol |
D.n(Al)=
| 1.8g |
| 27g/mol |
| 2 |
| 30 |
| 2.4g |
| 24g/mol |
故选C.
点评:本题考查化学方程式的计算,题目难度中等,注意根据化学方程式结合差量法计算,易错点为A,注意判断反应物的过量问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
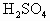 各20mL,向左盘的烧杯中加入10g的Zn,为了保持天平的平衡,应当向右盘的烧杯中放入铁的质量是
各20mL,向左盘的烧杯中加入10g的Zn,为了保持天平的平衡,应当向右盘的烧杯中放入铁的质量是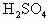 各20mL,向左盘的烧杯中加入10g的Zn,为了保持天平的平衡,应当向右盘的烧杯中放入铁的质量是
各20mL,向左盘的烧杯中加入10g的Zn,为了保持天平的平衡,应当向右盘的烧杯中放入铁的质量是