题目内容
【题目】钴是重要的战略金属,钴及其化合物广泛用于航空、航天、电器、机械制造、磁性材料、化学和陶瓷等工业,在国民经济和社会发展中具有特殊意义。水钴矿是钴的重要来源。水钴矿中除SiO2外,还有9.24﹪CoO、2.78﹪Fe2O3、0.96﹪MgO、0.084﹪CaO,从中提取钴的工艺流程如下:

(1)浸出液是多种硫酸盐的混合液,其中的溶质主要有_____________(填化学式)
(2)除铁时,溶液中的铁转化为难溶的Na2Fe6(SO4)4(OH)12,写出该反应的化学方程式_____________
(3)“除钙、镁”的反应原理如下:
MgSO4+2NaF=MgF2↓+Na2SO4 CaSO4+2NaF=CaF2↓+Na2SO4
已知Ksp(CaF2)=1.11×10-10, Ksp(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,滤液中c(Ca2+)/c(Mg2+)=_________。
(4)“沉淀”表面吸附的杂质离子主要有SO42-、F-、______和______,“操作X”包括_______和_________
(5)二水草酸钴在350℃进行分解时,先脱除结晶水,形成无水草酸钴结晶体。然后分解出二氧化碳,获得金属钴,写出反应方程式:__________________
【答案】 CoSO4、Fe2(SO4)3、MgSO4、CaSO4 3Fe2(SO4)3 + 6H2O + 6Na2CO3 = Na2Fe6(SO4)4(OH2)↓+ 5Na2SO4 + 6CO2↑ 1.5 NH4+ Na+ 洗涤 干燥 CoC2O4·2H2O ![]() CoC2O4 + 2H2O;CoC2O4
CoC2O4 + 2H2O;CoC2O4 ![]() Co + 2CO2↑
Co + 2CO2↑
【解析】水钴矿磨矿将矿石粉碎,增大接触面积,加快反应速率,加入稀硫酸,矿渣为SiO2,滤液中含有:CoSO4、Fe2(SO4)3、MgSO4、CaSO4,加入碳酸钠,除去Fe2(SO4)3,加入氟化钠,除去钙镁,过滤得主要含CoSO4的溶液,加入草酸铵,通过沉淀、过滤、洗涤、干燥得到四水合草酸钴。
(1)根据上述分析,浸出液是多种硫酸盐的混合液,其中的溶质主要有CoSO4、Fe2(SO4)3、NgSO4、CaSO4,故答案为:CoSO4、Fe2(SO4)3、MgSO4、CaSO4;
(2)除铁时,在Fe2(SO4)3溶液中加入碳酸钠溶液生成难溶的Na2Fe6(SO4)4(OH)12,反应的化学方程式为3Fe2(SO4)3 + 6H2O + 6Na2CO3 = Na2Fe6(SO4)4(OH2)↓+ 5Na2SO4 + 6CO2↑,故答案为:3Fe2(SO4)3 + 6H2O + 6Na2CO3 = Na2Fe6(SO4)4(OH2)↓+ 5Na2SO4 + 6CO2↑;
(3) 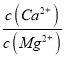 =
=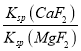 =
=![]() =1.5;故答案为:1.5;
=1.5;故答案为:1.5;
(4)该沉淀中吸附易溶于水的离子,根据流程图知,溶液中含有铵根离子和钠离子,所以沉淀上含有铵根离子和钠离子,得到的沉淀要进行洗涤和干燥才能得到较纯净、干燥的物质, 故答案为:NH4+;Na+;洗涤、干燥;
(5)二水草酸钴在350℃进行分解时,先脱除结晶水,形成无水草酸钴结晶体,反应方程式为CoC2O4·2H2O ![]() CoC2O4 + 2H2O。然后CoC2O4分解出二氧化碳和金属钴,反应方程式为CoC2O4
CoC2O4 + 2H2O。然后CoC2O4分解出二氧化碳和金属钴,反应方程式为CoC2O4 ![]() Co + 2CO2↑,故答案为:CoC2O4·2H2O
Co + 2CO2↑,故答案为:CoC2O4·2H2O ![]() CoC2O4 + 2H2O;CoC2O4
CoC2O4 + 2H2O;CoC2O4 ![]() Co + 2CO2↑。
Co + 2CO2↑。

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案