题目内容
请完成有关氨气的问题。
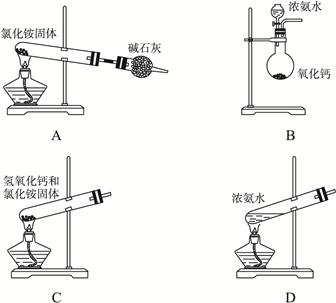
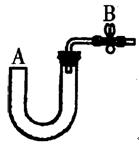
(1)实验室常用下列装置和选用的试剂制取NH3,其中正确的是__________(填序号)。
(2)若实验室收集NH3要采用法__________。
(3)若检验NH3,可用__________。
(1)实验室常用下列装置和选用的试剂制取NH3,其中正确的是__________(填序号)。

(2)若实验室收集NH3要采用法__________。
(3)若检验NH3,可用__________。
(1)B、D
(2)向下排空气
(3)湿润的红色石蕊试纸变蓝(或用蘸取浓盐酸的玻璃棒,接近容器口,将产生大量的白烟)
(2)向下排空气
(3)湿润的红色石蕊试纸变蓝(或用蘸取浓盐酸的玻璃棒,接近容器口,将产生大量的白烟)
(1)C装置不对,试管口应略低于试管底部,A装置在试管口部位又生成NH4Cl得不到NH3。(2)NH3易溶于水且比空气轻。(3)利用NH3·H3O易分解生成NH3的性质。

练习册系列答案
相关题目
 。请回答:
。请回答: 成 功
成 功 成 功
成 功