题目内容
 元素H、C、N、O、F都是重要的非金属元素,Fe、Cu是应用非常广泛的金属.
元素H、C、N、O、F都是重要的非金属元素,Fe、Cu是应用非常广泛的金属.(1)Fe元素基态原子的核外电子排布式为
(2)C、H元素形成的化合物分子中共有16个电子,该分子中σ键与π键的个数 比为
(3)C、N、O三种元素的第一电离能由大到小的顺序为(用元素符号表示)
(3)在测定HF的相对分子质量时,实验测得值一般高于理论值,其主要原因是
(5)C、N两元素形成的化合物C3N4形成的原子晶体,结构类似 金刚石,甚至硬度超过金刚石,其原因是
(6)如图为石墨晶胞结构示意图,该晶胞中含有C原子的个数为
分析:(1)Fe是26元素,核外电子数为26,根据核外电子排布规律书写;
(2)C、H元素形成的化合物分子中共有16个电子,该烃分子式为C2H4,分子中含有4个C-H、1个C=C双键,双键为1个σ键、1π键;
(3)同周期自左而右元素第一电离能呈增大趋势,但N元素原子的2p能级含有3个电子,处于半满稳定状态,能量较低,失去第1个电子需要的能量较大;
(4)F元素电负性很大,分子之间形成氢键,以形成缔合分子;
(5)原子晶体中化学键键长越短,键能越大,化学键越稳定;
(6)由石墨晶胞结构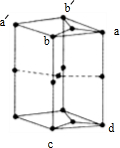 可知,∠bab′=60°,∠aba′=120°,故顶点a相应位置碳原子为12个晶胞共用,顶点b相应位置为棱上碳原子为6个晶胞共用,面上为2个晶胞共用,晶胞内部含有1个碳原子,ad相应棱上碳原子为6个晶胞共用,bc相应棱上碳原子为3个晶胞共用,利用相应物质均摊法计算.
可知,∠bab′=60°,∠aba′=120°,故顶点a相应位置碳原子为12个晶胞共用,顶点b相应位置为棱上碳原子为6个晶胞共用,面上为2个晶胞共用,晶胞内部含有1个碳原子,ad相应棱上碳原子为6个晶胞共用,bc相应棱上碳原子为3个晶胞共用,利用相应物质均摊法计算.
(2)C、H元素形成的化合物分子中共有16个电子,该烃分子式为C2H4,分子中含有4个C-H、1个C=C双键,双键为1个σ键、1π键;
(3)同周期自左而右元素第一电离能呈增大趋势,但N元素原子的2p能级含有3个电子,处于半满稳定状态,能量较低,失去第1个电子需要的能量较大;
(4)F元素电负性很大,分子之间形成氢键,以形成缔合分子;
(5)原子晶体中化学键键长越短,键能越大,化学键越稳定;
(6)由石墨晶胞结构
 可知,∠bab′=60°,∠aba′=120°,故顶点a相应位置碳原子为12个晶胞共用,顶点b相应位置为棱上碳原子为6个晶胞共用,面上为2个晶胞共用,晶胞内部含有1个碳原子,ad相应棱上碳原子为6个晶胞共用,bc相应棱上碳原子为3个晶胞共用,利用相应物质均摊法计算.
可知,∠bab′=60°,∠aba′=120°,故顶点a相应位置碳原子为12个晶胞共用,顶点b相应位置为棱上碳原子为6个晶胞共用,面上为2个晶胞共用,晶胞内部含有1个碳原子,ad相应棱上碳原子为6个晶胞共用,bc相应棱上碳原子为3个晶胞共用,利用相应物质均摊法计算.解答:解:(1)Fe是26元素,核外电子数为26,态原子的核外电子排布式为1s22s22p63s23p63d64s2,
故答案为:1s22s22p63s23p63d64s2;
(2)C、H元素形成的化合物分子中共有16个电子,该烃分子式为C2H4,分子中含有4个C-H、1个C=C双键,双键为1个σ键、1π键,故该分子中σ键与π键的个数比为5:1,
故答案为:5:1;
(3)同周期自左而右第一电离能呈增大趋势,N元素原子的2p能级有3个电子,为半满稳定状态,能量降低,失去第一个电子需要的能量较高,第一电离能高于同周期相邻元素,故第一电离能N>O>C,
故答案为:N>O>C;
(4)F元素电负性很大,分子之间形成氢键,以形成缔合分子(HF)n,实验测得HF的相对分子质量一般高于理论值,
故答案为:F元素电负性很大,分子之间形成氢键,以形成缔合分子(HF)n;
(5)N原子半径小于C原子半径,键长C-N<C-C,故在C3N4形成的原子晶体中C-N键能更大,故其硬度超过金刚石,
故答案为:N原子半径小于C原子半径,键长C-N<C-C,C-N键能更大;
(6)由石墨晶胞结构 可知,∠bab′=60°,∠aba′=120°,故顶点a相应位置碳原子为12个晶胞共用,顶点b相应位置为棱上碳原子为6个晶胞共用,面上为2个晶胞共用,晶胞内部含有1个碳原子,ad相应棱上碳原子为6个晶胞共用,bc相应棱上碳原子为3个晶胞共用,故晶胞中含有的AC原子数目为:
可知,∠bab′=60°,∠aba′=120°,故顶点a相应位置碳原子为12个晶胞共用,顶点b相应位置为棱上碳原子为6个晶胞共用,面上为2个晶胞共用,晶胞内部含有1个碳原子,ad相应棱上碳原子为6个晶胞共用,bc相应棱上碳原子为3个晶胞共用,故晶胞中含有的AC原子数目为:
4×
+4×
+2×
+1+2×
+2×
=4,故答案为:4.
故答案为:1s22s22p63s23p63d64s2;
(2)C、H元素形成的化合物分子中共有16个电子,该烃分子式为C2H4,分子中含有4个C-H、1个C=C双键,双键为1个σ键、1π键,故该分子中σ键与π键的个数比为5:1,
故答案为:5:1;
(3)同周期自左而右第一电离能呈增大趋势,N元素原子的2p能级有3个电子,为半满稳定状态,能量降低,失去第一个电子需要的能量较高,第一电离能高于同周期相邻元素,故第一电离能N>O>C,
故答案为:N>O>C;
(4)F元素电负性很大,分子之间形成氢键,以形成缔合分子(HF)n,实验测得HF的相对分子质量一般高于理论值,
故答案为:F元素电负性很大,分子之间形成氢键,以形成缔合分子(HF)n;
(5)N原子半径小于C原子半径,键长C-N<C-C,故在C3N4形成的原子晶体中C-N键能更大,故其硬度超过金刚石,
故答案为:N原子半径小于C原子半径,键长C-N<C-C,C-N键能更大;
(6)由石墨晶胞结构
 可知,∠bab′=60°,∠aba′=120°,故顶点a相应位置碳原子为12个晶胞共用,顶点b相应位置为棱上碳原子为6个晶胞共用,面上为2个晶胞共用,晶胞内部含有1个碳原子,ad相应棱上碳原子为6个晶胞共用,bc相应棱上碳原子为3个晶胞共用,故晶胞中含有的AC原子数目为:
可知,∠bab′=60°,∠aba′=120°,故顶点a相应位置碳原子为12个晶胞共用,顶点b相应位置为棱上碳原子为6个晶胞共用,面上为2个晶胞共用,晶胞内部含有1个碳原子,ad相应棱上碳原子为6个晶胞共用,bc相应棱上碳原子为3个晶胞共用,故晶胞中含有的AC原子数目为:4×
| 1 |
| 12 |
| 1 |
| 6 |
| 1 |
| 2 |
| 1 |
| 6 |
| 1 |
| 3 |
点评:本题考查核外电子排布规律、电离能、氢键、晶体性质、晶胞计算等,难度中等,(6)中碳原子数目计算为难点、易错点,学生容易按立方体进行计算,但不影响计算结果,要考虑石墨层为正六边形结构,确定图中上下面不是矩形.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物. [化学-物质结构与性质]
[化学-物质结构与性质] 键与
键与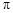 键的个数比为
键的个数比为 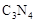 形成的原子晶体,结构类似
形成的原子晶体,结构类似
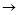 C的反应类型为 ,D中官能团的名称为 。
C的反应类型为 ,D中官能团的名称为 。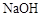 溶液反应,理论上消耗
溶液反应,理论上消耗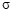 键与
键与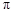 键的个数比为
键的个数比为 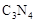 形成的原子晶体,结构类似
形成的原子晶体,结构类似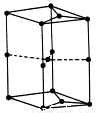

 C的反应类型为 ,D中官能团的名称为 。
C的反应类型为 ,D中官能团的名称为 。 溶液反应,理论上消耗
溶液反应,理论上消耗