题目内容
【题目】【山西省实验中学2017届下学期模拟热身】五种短周期元素A、B、C、D、E的性质及结构信息如下:
① 原子半径A>B>C>D>E;
② 五种元素之间形成的常见的四种分子如下:
甲 | 乙 | 丙 | 丁 | |
比例模型 |
|
|
|
|
组成元素 | D、E | B、E | A、D、E | C、E |
电子总数 | 10 | 18 | 26 | 10 |
请根据上述信息回答下列问题:
(1)A元素的单质与物质甲发生反应的离子方程式为_______,其化学反应平衡常数的表达式为___。
(2)戊与乙互为同系物,有五种同分异构体,戊的分子式为_____,己与乙具有相同的电子数,与甲含有的元素种类相同,己分子的结构式为_______。
(3)C与E元素组成的CE3与液氮可组成燃料电池,产物均为无污染的物质,可用于驱动潜艇,燃料电池装置如下图所示。该电池的负极反应式为_____。电池工作时OH-向_____移动(填“正极”或“负极”)。

(4)B与D组成的一种物质在自然界中可循环,循环时其与CaCO3反应。已知Ksp(CaCO3)=2.8×10-9,现将CaCl2溶液与Na2CO3溶液等体积混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀的最小浓度为__________(忽略混合前后溶液的体积变化)。
【答案】Cl2+H2O=Cl-+H++HClO 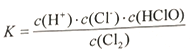 C6H14 H-O-O-H 2NH3-6e-+6OH-=N2+6H2O 负极 5.6×10-5mol/L
C6H14 H-O-O-H 2NH3-6e-+6OH-=N2+6H2O 负极 5.6×10-5mol/L
【解析】根据五种元素之间形成的常见的四种分子的比例模型结合原子半径A>B>C>D>E,可知,甲为水分子,乙为乙烷分子,丙为HClO分子,丁为氨气分子,则A为Cl、B为C、C为N、D为O、E为H。
(1)氯气与水反应的离子方程式为Cl2+H2O=Cl-+H++HClO,其化学反应平衡常数的表达式K=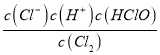 ;
;
(2)有五种同分异构体的烷烃的分子式为C6H14,己与乙烷具有相同的电子数,与水含有的元素种类相同,则己为过氧化氢,结构式为H-O-O-H;
(3)NH3与液氮可组成燃料电池,产物均为无污染的物质,水和氮气,氨气在负极发生氧化反应,电极反应式为2NH3-6e-+6OH-=N2+6H2O,根据电极反应式,电池工作时OH-向负极移动;
(4) Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1×10-4mol/L,根据Ksp=c(CO32-)c(Ca2+)=2.8×10-9可知,c(Ca2+)=![]() mol/L=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L。
mol/L=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】为了提纯下列物质(括号内为杂质),除杂试剂和分离方法均正确的是
选项 | 待提纯的物质 | 除杂试剂 | 分离方法 |
A | 乙醇(乙醇钠) | Na | 过滤 |
B | 溴苯(Br2) | 苯 | 萃取 |
C | 苯甲酸(NaCl) | 水 | 重结晶 |
D | 苯(苯酚) | NaOH溶液 | 蒸馏 |
A. A B. B C. C D. D


