题目内容
已知某温度下在密闭容器中加入CH3OH,发生如下可逆反应:
2CH3OH(g)==CH3OCH3(g)+H2O(g),反应到某时刻测得各组分的物质的量浓度(mol·L-1)如下,下列有关说法不正确的是( )
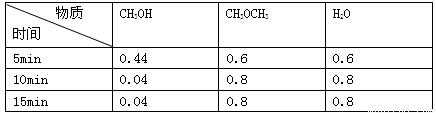
A.10min时v正=v逆
B.5min时该反应速率v(CH3OH)=0.088mol·L-1·min-1
C.该温度下此反应的平衡常数k=400
D.平衡后其它条件不变,升温,c(CH3OH)=0.06mol/L,该反应△H<0
B
【解析】略

(12分)某温度下,容积同为2L的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
(已知某温度下2HI(g) H2 (g)+I2 (g) ![]() =+A kJ·mol
=+A kJ·mol![]() K=4.0)
K=4.0)
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2 mol HI | 1 mol H2 + 1 1mol I2 | 2 mol HI + 1 mol H2 + 1 mol I2 |
| HI的浓度(mol·L | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 |
|
|
|
(1)根据上表回答问题
①c1、c3的关系式为
②a、b的关系式为
③p2、p3的关系式为
④![]() 与
与 的关系式为
的关系式为
(2)甲容器中:该反应的平衡常数表达式为 。
(3)乙容器中:反应在开始2分钟后达平衡状态,则该反应在这2分钟的平均反应速率为 mol·L![]() ·min
·min![]() (用含有c2的代数式表示)
(用含有c2的代数式表示)
(4)丙容器中:反应开始时进行的方向是 (填“向左”、“向右”或“不动”)
(5)乙容器中:当反应达到平衡状态后,向容器中再充入1 mol H2 ,则1分钟后,正反应速率与原平衡时相比 (填“增大”、“不变”或“减小”)
(12分)某温度下,容积同为2L的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
(已知某温度下2HI(g) H2 (g)+I2 (g)  =
+A kJ·mol
=
+A kJ·mol K=4.0)
K=4.0)
|
容器 |
甲 |
乙 |
丙 |
|
反应物投入量 |
2 mol HI |
1 mol H2 + 1 1mol I2 |
2 mol HI + 1 mol H2 + 1 mol I2 |
|
HI的浓度(mol·L |
c1 |
c2 |
c3 |
|
反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
|
体系压强(Pa) |
p1 |
p2 |
p3 |
|
反应物转化率 |
|
|
|
(1)根据上表回答问题
①c1、c3的关系式为
②a、b的关系式为
③p2、p3的关系式为
④ 与
与 的关系式为
的关系式为
(2)甲容器中:该反应的平衡常数表达式为 。
(3)乙容器中:反应在开始2分钟后达平衡状态,则该反应在这2分钟的平均反应速率为
mol·L ·min
·min (用含有c2的代数式表示)
(用含有c2的代数式表示)
(4)丙容器中:反应开始时进行的方向是 (填“向左”、“向右”或“不动”)
(5)乙容器中:当反应达到平衡状态后,向容器中再充入1 mol H2 ,则1分钟后,正反应速率与原平衡时相比 (填“增大”、“不变”或“减小”)
某温度下,容积同为2L的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
(已知某温度下2HI(g) ![]() H2 (g)+I2 (g)
H2 (g)+I2 (g) ![]() = +A kJ·mol
= +A kJ·mol![]() K=4.0)
K=4.0)
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2 mol HI | 1 mol H2 + 1 1mol I2 | 2 mol HI + 1 mol H2 + 1 mol I2 |
| HI的浓度(mol·L | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 |
|
|
|
(1)根据上表回答问题
①c1、c3的关系式为
②a、b的关系式为
③p2、p3的关系式为
④![]() 与
与![]() 的关系式为
的关系式为
(2)甲容器中:该反应的平衡常数表达式为 。
(3)乙容器中:反应在开始2分钟后达平衡状态,则该反应在这2分钟的平均反应速率为 mol·L![]() ·min
·min![]() (用含有c2的代数式表示)
(用含有c2的代数式表示)
(4)丙容器中:反应开始时进行的方向是 (填“向左”、“向右”或“不动”)
(5)乙容器中:当反应达到平衡状态后,向容器中再充入1 mol H2 ,则1分钟后,正反应速率与原平衡时相比 (填“增大”、“不变”或“减小”)


 2C(g)。在该温度下,向容积为2L的恒容密闭容器中加入2 mol A和2 mol B,在1min时达到平衡,混合气体中C的体积分数[x(C)]随时间(t)变化曲线如下图所示,在2min时再向此容器中加入2 mol C,在3min时反应重新达到平衡至4min。求:
2C(g)。在该温度下,向容积为2L的恒容密闭容器中加入2 mol A和2 mol B,在1min时达到平衡,混合气体中C的体积分数[x(C)]随时间(t)变化曲线如下图所示,在2min时再向此容器中加入2 mol C,在3min时反应重新达到平衡至4min。求: