题目内容
氢化亚铜(CuH)是一种不稳定的物质,能在氯气中燃烧,也能与酸反应。用CuSO4溶液和“某物质”在40~50 ℃时反应可生成CuH。下列叙述中错误的是( )。
| A.“某物质”具有还原性 |
| B.CuH与盐酸反应可能产生H2 |
| C.CuH与足量稀硝酸反应:CuH+3H++NO3-=Cu2++NO↑+2H2O |
| D.CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl |
D
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列化工生产过程中发生的反应,不属于氧化还原反应的是
| A.用氨气制硝酸 | B.用石灰石制生石灰 |
| C.用氯气制漂白粉 | D.从卤水中提取溴单质 |
有一铁的氧化物样品,用140 mL 5 mol·L-1盐酸可恰好使其完全溶解。所得溶液可吸收标准状况下0.56 L氯气,使其中的Fe2+全部转化为Fe3+。该样品可能的化学式为
| A.Fe3O4 | B.Fe2O3 | C.Fe5O7 | D.Fe4O5 |
在100mL混合酸的溶液中,硝酸的物质的量浓度为0.4mol/L,硫酸的物质的量浓度为0.2mol/L,向其中加入6.4g铜粉,微热,使其充分反应,生成NO的物质的量
| A.0.1mol | B.0.03mol | C.0.02mol | D.0.04mol |
下列实验现象与氧化还原反应有关的是
| A.蘸有浓盐酸和浓氨水的玻璃棒互相靠近,产生大量白烟 |
| B.向硅酸钠溶液中滴加适量的稀盐酸,有透明的凝胶形成 |
| C.将装有NO2 的试管倒立于水中,管内气体由红棕色逐渐转变为无色 |
| D.硫酸铁溶液中滴加硫氰化钾溶液变红 |
已知NH4CuSO3与足量的2 mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成;②产生刺激性气味的气体;③溶液呈现蓝色。据此判断下列说法正确的是
| A.反应中硫酸做氧化剂 |
| B.NH4CuSO3中硫元素被氧化 |
| C.1 mol NH4CuSO3完全反应转移0.5 mol电子 |
| D.刺激性气味的气体是氨气 |
一定体积0.01 mol·L-1的稀硝酸恰好能氧化一定质量的铁、铝混合物,已知两种金属均被氧化为最高价态,还原产物只有NO。若用0.01 mol·L-1 NaOH溶液溶解相同质量的该混合物,当反应完全时所需氢氧化钠溶液的体积是稀硝酸的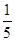 ,则样品中铁、铝的物质的量之比为( )。
,则样品中铁、铝的物质的量之比为( )。
| A.2∶3 | B.1∶3 | C.1∶4 | D.5∶3 |
已知常温下可用Co2O3制备Cl2,反应前后存在六种微粒:Co2O3、H2O、Cl2、H+、Cl-和Co2+。下列叙述不正确的是 ( )。
| A.氧化产物为Cl2 |
| B.参加反应的氧化剂与还原剂的物质的量之比为1∶2 |
| C.若有3 mol H2O生成,则反应中有2 mol电子转移 |
| D.当该反应生成2.24 L Cl2(标准状况)时,反应中有0.1 mol电子转移 |