题目内容
(2011?西城区一模)铬铁矿的主要成分可表示为FeO?Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示.

已知:①NaFeO2遇水强烈水解.②Cr2O72-+H2O 2CrO42-+2H+
2CrO42-+2H+
请回答:
(1)K2Cr2O7中Cr元素的化合价是
(2)生成滤渣1中红褐色物质的反应的化学方程式是
(3)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是
(4)由滤液2转化为Na2Cr2O7溶液应采取的措施是
(5)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、
(6)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是

已知:①NaFeO2遇水强烈水解.②Cr2O72-+H2O
 2CrO42-+2H+
2CrO42-+2H+请回答:
(1)K2Cr2O7中Cr元素的化合价是
+6
+6
.(2)生成滤渣1中红褐色物质的反应的化学方程式是
NaFeO2+2H2O=NaOH+Fe(OH)3↓
NaFeO2+2H2O=NaOH+Fe(OH)3↓
.滤液1的成分除Na2CrO4外,还含有(填化学式)NaAlO2、Na2SiO3和NaOH
NaAlO2、Na2SiO3和NaOH
.(3)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是
2Al2O3(熔融)
4Al+3O2↑
| ||
2Al2O3(熔融)
4Al+3O2↑
.
| ||
(4)由滤液2转化为Na2Cr2O7溶液应采取的措施是
加硫酸酸化
加硫酸酸化
.(5)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、
冷却结晶
冷却结晶
、过滤、洗涤、干燥.(6)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是
4FeO?Cr2O3+7O2+20NaOH
8Na2CrO4+4NaFeO2+10H2O
| ||
4FeO?Cr2O3+7O2+20NaOH
8Na2CrO4+4NaFeO2+10H2O
.
| ||
分析:(1)根据化合价规则来计算元素的化合价;
(2)根据NaFeO2的性质以及氧化铝和二氧化硅的性质来回答;
(3)工业上电解氧化铝来生产金属铝;
(4)铬酸根在酸性条件下可以转化为重铬酸根;
(5)根据物质的溶解度随温度的变化来分析;
(6)根据Na2CrO4和NaFeO2的性质来回答.
(2)根据NaFeO2的性质以及氧化铝和二氧化硅的性质来回答;
(3)工业上电解氧化铝来生产金属铝;
(4)铬酸根在酸性条件下可以转化为重铬酸根;
(5)根据物质的溶解度随温度的变化来分析;
(6)根据Na2CrO4和NaFeO2的性质来回答.
解答:解:(1)根据化合价规则:化合物中各个元素的化合价代数和是0,K是+1价,O是-2价,所以K2Cr2O7中Cr元素的化合价是+6,故答案为:+6;
(2)NaFeO2和水反应会产生红褐色沉淀,即NaFeO2+2H2O=NaOH+Fe(OH)3↓,生成的氢氧化钠和氧化铝反应生成偏铝酸钠,和二氧化硅反应生成硅酸钠,滤液1的成分除Na2CrO4外,还含有偏铝酸钠和硅酸钠,故答案为:NaFeO2+2H2O=NaOH+Fe(OH)3↓;NaAlO2、Na2SiO3和NaOH;
(3)滤渣2可制得两种氧化物,其中一种氧化物氧化铝经电解冶炼可获得金属铝,该电解反应的化学方程式是:2Al2O3(熔融)
4Al+3O2↑,
故答案为:2Al2O3(熔融)
4Al+3O2↑;
(4)根据题目信息:Cr2O72-+H2O 2CrO42-+2H+,所以滤液2中的铬酸钠转化为Na2Cr2O7溶液应采取的措施是加硫酸酸化,故答案为:加硫酸酸化;
2CrO42-+2H+,所以滤液2中的铬酸钠转化为Na2Cr2O7溶液应采取的措施是加硫酸酸化,故答案为:加硫酸酸化;
(5)向Na2Cr2O7溶液中加入KCl固体,加热时,重铬酸钠的溶解度随温度的升高而增大,但是氯化钾的受温度影响不大,所以获得K2Cr2O7晶体的操作依次是:加热浓缩、冷却结晶、、过滤、洗涤、干燥,故答案为:冷却结晶;
(6)Na2CrO4和NaFeO2反应的化学方程式是:4FeO?Cr2O3+7O2+20NaOH
8Na2CrO4+4NaFeO2+10H2O,故答案为:4FeO?Cr2O3+7O2+20NaOH
8Na2CrO4+4NaFeO2+10H2O.
(2)NaFeO2和水反应会产生红褐色沉淀,即NaFeO2+2H2O=NaOH+Fe(OH)3↓,生成的氢氧化钠和氧化铝反应生成偏铝酸钠,和二氧化硅反应生成硅酸钠,滤液1的成分除Na2CrO4外,还含有偏铝酸钠和硅酸钠,故答案为:NaFeO2+2H2O=NaOH+Fe(OH)3↓;NaAlO2、Na2SiO3和NaOH;
(3)滤渣2可制得两种氧化物,其中一种氧化物氧化铝经电解冶炼可获得金属铝,该电解反应的化学方程式是:2Al2O3(熔融)
| ||
故答案为:2Al2O3(熔融)
| ||
(4)根据题目信息:Cr2O72-+H2O
 2CrO42-+2H+,所以滤液2中的铬酸钠转化为Na2Cr2O7溶液应采取的措施是加硫酸酸化,故答案为:加硫酸酸化;
2CrO42-+2H+,所以滤液2中的铬酸钠转化为Na2Cr2O7溶液应采取的措施是加硫酸酸化,故答案为:加硫酸酸化;(5)向Na2Cr2O7溶液中加入KCl固体,加热时,重铬酸钠的溶解度随温度的升高而增大,但是氯化钾的受温度影响不大,所以获得K2Cr2O7晶体的操作依次是:加热浓缩、冷却结晶、、过滤、洗涤、干燥,故答案为:冷却结晶;
(6)Na2CrO4和NaFeO2反应的化学方程式是:4FeO?Cr2O3+7O2+20NaOH
| ||
| ||
点评:本题是一道关于铁的化合物知识的综合题目,考察角度很广,难度很大.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
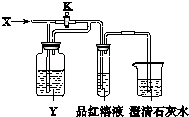 (2011?西城区一模)向如图所示的装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色.X和Y可能是( )
(2011?西城区一模)向如图所示的装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色.X和Y可能是( )