题目内容
【题目】唐山市打造“山水园林城市”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
SO2(g)+NH3·H2O(aq)![]() NH4HSO3(aq) ΔH1=a kJ·mol1;
NH4HSO3(aq) ΔH1=a kJ·mol1;
NH3·H2O(aq)+ NH4HSO3(aq)![]() (NH4)2SO3(ag)+H2O(l) ΔH 2=b kJ·mol1;
(NH4)2SO3(ag)+H2O(l) ΔH 2=b kJ·mol1;
2(NH4)2SO3(aq)+O2(g)![]() 2(NH4)2SO4(aq) ΔH 3=c kJ·mol1。
2(NH4)2SO4(aq) ΔH 3=c kJ·mol1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g) ![]() 2(NH4)2SO4(aq)+2H2O(l)的ΔH =____kJ·mol1。
2(NH4)2SO4(aq)+2H2O(l)的ΔH =____kJ·mol1。
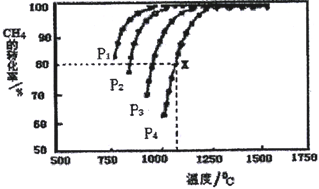
(2)以乙烯(C2H4)作为还原剂脱硝(NO),脱硝机理如图1,则总反应的化学方程式为_______;脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2,为达到最佳脱硝效果,应采用的条件是______。

(3)T1温度时在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0。实验测得:υ正=υ(NO)消耗=2υ(O2)消耗=k正c2(NO)·c(O2),υ逆=(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
2NO2(g) △H<0。实验测得:υ正=υ(NO)消耗=2υ(O2)消耗=k正c2(NO)·c(O2),υ逆=(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 1 | 0.6 | 0.4 | 0.2 | 0.2 | 0.2 |
n(O2)/mol | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 |
①T1温度时k正/k逆=__________ L/mol。
②若将容器的温度改变为T2时其k正=k逆,则T2__________T1(填“>”、“<”或“=")。
(4)已知:N2(g)+O2(g)![]() 2NO(g) △H=+181.5 kJ·mol-1,某科研小组尝试利用固体表面催化工艺进行NO的分解。若用
2NO(g) △H=+181.5 kJ·mol-1,某科研小组尝试利用固体表面催化工艺进行NO的分解。若用![]() 、
、![]() 、
、![]() 和
和![]() 分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是___(填字母序号)。
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是___(填字母序号)。

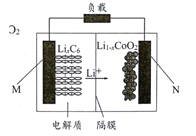
(5)利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度的10倍),装置示意图如下,固体电解质可传导O2-

①阴极的电极反应式为______。
②消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)_________。
【答案】2a+2b+c 6NO+3O2+2C2H4![]() 3N2+4CO2+4H2O 350℃左右、负载率3.0% 160 > C 2NO+4e-=N2+2O2- 阴极发生副反应O2+4e-=2O2-
3N2+4CO2+4H2O 350℃左右、负载率3.0% 160 > C 2NO+4e-=N2+2O2- 阴极发生副反应O2+4e-=2O2-
【解析】
(1)根据盖斯定律,将已知的热化学方程式叠加,可得相应反应的热化学方程式;
(2)由图1可知,在催化剂的作用下,C2H4与NO、O2反应最终生成N2、CO2、H2O, 据此写出反应的总方程式;根据图2可知,为达到最佳脱硝效果,应满足脱硝率高,负载率低,适宜的温度;
(3)①根据k正/k逆=c2(NO2)/c2(NO)·c(O2)=K,依据表格数据列出三段式求出结论;
②k正=k逆时,则K=1,利用K与温度的关系作答;
(4)该分解反应为放热反应;
(5)①阴极是NO得到电子生成O2-和N2;
②电解装置中下电极板上存在有O2,容易在阴极发生副反应;
(1)根据盖斯定律,将①×2+②×2+③可得2SO2(g)+4NH3H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(1) 的△H=(2a+2b+c)kJ/mol;
(2)①根据图1可以知道,在催化剂的作用下,C2H4与NO、O2反应最终生成N2、CO2、H2O,反应总方程式为: 6NO+3O2+2C2H4![]() 3N2+4CO2+4H2O;由图可知,b曲线的最高点处,脱硝率高,负载率低,温度适宜,适宜适合条件为350℃、负载率3.0%;
3N2+4CO2+4H2O;由图可知,b曲线的最高点处,脱硝率高,负载率低,温度适宜,适宜适合条件为350℃、负载率3.0%;
(3)①根据v正=v(NO)消耗=2v(O2)消耗= k正c2(NO)·c(O2),得出k正=v(NO)消耗/c2(NO)·c(O2),根据v逆=v(NO2)消耗= k逆c2(NO2),得出k逆= v(NO2)消耗/c2(NO2),因为v(NO)消耗= v(NO2)消耗,所以k正/k逆= c2(NO2)/ [c2(NO)·c(O2)]=K,表格中初始物质的量:n(NO)=1mol,n(O2)=0.6mol,体积为2L,则列出三段式如下:
2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
起(mol·L-1) 0.5 0.3 0
转(mol·L-1) 0.4 0.2 0.4
平(mol·L-1) 0.1 0.1 0.4
K= c2(NO2)/[c2(NO)·c(O2)]= (0.4mol/L)2/[(0.1 mol/L) 2×(0.1 mol/L)]=160 L/mol,故答案为:160;
②若将容器的温度改变为T2时其k正=k逆,则K=1<160,因反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0,反应放热,K值减小,则对应的温度增大,即T2>T1;
2NO2(g) △H<0,反应放热,K值减小,则对应的温度增大,即T2>T1;
(4)A→B是NO断键转化为氮原子和氧原子,B→C是氮原子与氮原子结合转化为氮气,氧原子与氧原子结合转化为氧气,断键吸热,成键放热,故能量最低的状态是C处;
(5)①阴极是NO得到电子生成O2-和N2,其电极反应式为:2NO +4e-== N2↑+ 2O2-;
②因O2浓度约为NO浓度的十倍,且电解装置中下电极板上存在有O2,容易在阴极发生副反应:O2+4e-==2O2-,导致耗能远高于理论值。