题目内容
【题目】(1)浓硫酸与木炭粉加热反应的化学方程式为:________________。
(2)试用下图中所列各装置设计一个实验,验证上述反应所产生的各种产物。这种装置的连接顺序(按产物气流从左到右的方向)是(填图中装置的编号):_______→________→________→________。
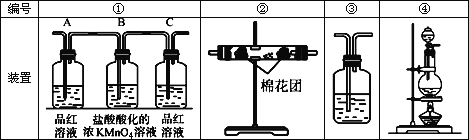
(3)实验时可观察到装置①中,A瓶的溶液褪色,C瓶的溶液不褪色。
A瓶溶液的作用是:___________________________________,
B瓶溶液的作用是_____________________________________,
C瓶溶液的作用是_____________________________________。
(4)装置②中所加的白色固体药品是_____________,可验证的产物是____________。
(5)装置③中所盛的溶液是__________________,可验证的产物是_____________。
(6)在各装置所盛的试剂不变的条件下,若装置的连接顺序为④→①→②→③,则可以检出的产物是_______________填化学式,下同),不能检出的产物是__________。
【答案】C+2H2SO4(浓)![]() 2SO2↑十CO2↑十2H2O↑ ④ ② ① ③ 验证产物气流中是否有SO2 将SO2全部氧化吸收 确证产物中SO2已被B瓶溶液全部氧化 无水CuSO4(或变色硅胶) 水蒸气 澄清石灰水 CO2 SO2、CO2 水蒸气
2SO2↑十CO2↑十2H2O↑ ④ ② ① ③ 验证产物气流中是否有SO2 将SO2全部氧化吸收 确证产物中SO2已被B瓶溶液全部氧化 无水CuSO4(或变色硅胶) 水蒸气 澄清石灰水 CO2 SO2、CO2 水蒸气
【解析】
(1)碳和浓硫酸加热条件下反应生成二氧化碳和二氧化硫和水,方程式为:C+2H2SO4(浓)![]() 2SO2↑十CO2↑十2H2O↑;
2SO2↑十CO2↑十2H2O↑;
(2)检验二氧化碳和二氧化硫时用到的溶液中均含有水,所以先检验水的存在,二氧化碳和二氧化硫均可以使澄清石灰水变浑浊,所以先检验二氧化硫,再除去,最后检验二氧化碳,所以顺序为:④→②→①→③;
(3)二氧化硫能使品红溶液褪色,A瓶检验产生的气体中是否含有二氧化硫,B瓶中高锰酸钾能反应二氧化硫,所以除去二氧化硫。C瓶再次检验二氧化硫是否全部被氧化;
(4)装置②是为了检验气体中是否含有水蒸汽,用无水CuSO4(或变色硅胶);
(5)装置③用来检验二氧化碳,应该用澄清石灰水;
(6)先通过①能检验二氧化硫再通过②不能检验水蒸气,后通过③能检验二氧化碳。所以能检验二氧化硫和二氧化碳,不能检验水蒸气。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4·7H2O的过程如图所示:

硼镁泥的主要成分如下表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
回答下列问题:
(1)“酸解”时应该加入的酸是_______,“滤渣1”中主要含有_________(写化学式)。
(2)“除杂”时加入次氯酸钙、氧化镁的作用分别是________、_______。
(3)判断“除杂”基本完成的检验方法是____________。
(4)分离滤渣3应趁热过滤的原因是___________。