题目内容
【题目】把煤作为燃料可以通过下列两种途径: 途径I:C(s)+O2(g) ![]() CO2(g)(放热Q1J)
CO2(g)(放热Q1J)
途径II:先制水煤气:C(s)+H2O(g)═CO(g)+H2(g)(吸热Q2J)再燃烧水煤气:
试回答下列问题:
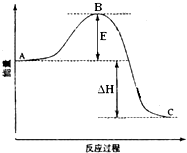
(1)判断两种途径放热:途径I放出的热量(填“大于”、“等于”、“小于”)途径II放出的热量.
(2)Q1、Q2、Q3的数学关系式是 .
(3)由于制取水煤气反应里,反应物所具有的总能量生成物所具有的总能量,那么在化学反应时,反应物应需要能量才能转化为生成物,因此其反应条件为 .
(4)简述煤通过途径II作为燃料的意义. .
【答案】
(1)等于
(2)![]() ﹣Q2
﹣Q2
(3)低于;吸收;高温
(4)固体煤经处理变为气体燃料后,不仅在燃烧时可以大大减少SO2和烟尘对大气造成的污染,而且燃烧效率高,也便于输送
【解析】解:(1)由盖斯定律可知:若是一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同,所以答案是:等于;(2)由盖斯定律可知:①C(s)+O2(g) ![]() CO2(g) (1mol碳单质反应放热Q1 kJ)②C(s)+H2O(g)
CO2(g) (1mol碳单质反应放热Q1 kJ)②C(s)+H2O(g) ![]() CO(g)+H2(g) (1mol碳单质反应吸热Q2 kJ)③2CO(g)+O2(g)
CO(g)+H2(g) (1mol碳单质反应吸热Q2 kJ)③2CO(g)+O2(g) ![]() 2CO2(g)
2CO2(g)
2H2(g)+O2(g) ![]() 2H2O(g)(1molCO和1molH2反应共放热Q3 kJ)
2H2O(g)(1molCO和1molH2反应共放热Q3 kJ)
根据盖斯定律①= ![]() ﹣②计算;
﹣②计算;
,所以Q1= ![]() ﹣Q2;所以答案是:
﹣Q2;所以答案是: ![]() ﹣Q2;(3)因吸热反应中,反应物所具有的总能量小于生成物所具有的总能量,以及在化学反应中能量守恒,所以反应物就需要吸收能量才能转化为生成物,所以答案是:低于;吸收;高温;(4)因煤通过途径Ⅱ作为燃料燃烧后产物无污染、燃烧效率高等,
﹣Q2;(3)因吸热反应中,反应物所具有的总能量小于生成物所具有的总能量,以及在化学反应中能量守恒,所以反应物就需要吸收能量才能转化为生成物,所以答案是:低于;吸收;高温;(4)因煤通过途径Ⅱ作为燃料燃烧后产物无污染、燃烧效率高等,
所以答案是:固体煤经处理变为气体燃料后,不仅在燃烧时可以大大减少SO2和烟尘对大气造成的污染,而且燃烧效率高,也便于输送.
【考点精析】掌握吸热反应和放热反应是解答本题的根本,需要知道化学上把吸收热量的化学反应称为吸热反应;化学上把放出热量的化学反应称为放热反应.

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案