题目内容
【题目】铜、银、金与社会生活联系密切。
(1)在元素周期表中,铜、银、金位于同一族,它们基态原子的外围电子排布式的通式为_________ (用n表示电子层数),它们处于元素周期表_________区。
(2)银氨溶液可用于检验醛基的存在。例如,CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H2O,a个CH3CHO分子中所含π键的数目为_________;NH3的VSEPR模型为_________。
CH3COONH4+2Ag↓+3NH3+H2O,a个CH3CHO分子中所含π键的数目为_________;NH3的VSEPR模型为_________。
(3)金不溶于硝酸,但溶于“王水”,会发生反应Au+4HCl+HNO3=H[AuCl4]+NO↑+2H2O。
金溶于“王水”的主要原因是形成了[AuCl4]-。提高了金的活泼性。在[AuCl4]-中金离子的配位数为_________,写出该配离子的结构式:________________________。
(4)金、银、铜都有良好的延展性,解释其原因:____________________。
(5)金、银的一种合金具有较强的储氢能力。该合金的晶胞为面心立方结构,银原子位于面心,金原子位于顶点。若该晶胞边长为anm,金、银原子的半径分别为bnm、cnm,则该晶胞的空间利用率(φ)为_________。
【答案】 (n-1)d10ns1 ds a 四面体 4 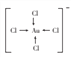 金属晶体中各原子层能相对滑动,且仍保持原来的排列方式
金属晶体中各原子层能相对滑动,且仍保持原来的排列方式 ![]() ×100%
×100%
【解析】(1)在元素周期表中,Cu、Ag、Au位于ⅠB族、各能级电子数相等价电子通式为(n-1)d10ns1,,它们处于元素周期表ds区;
(2)CH3CHO中有一个碳氧双键,双键中有一个π键,所以a个CH3CHO分子中π键的数目为a;NH3的N原子价层电子对个数=3+![]() =4,采用sp3杂化,含有3个共价单键和一个孤电子对,所以NH3的立体结构为正四面体;
=4,采用sp3杂化,含有3个共价单键和一个孤电子对,所以NH3的立体结构为正四面体;
(3))[AuCl4]-中,每个氯离子与金离子之间都形成一个配位键,所以有4个配位键,其结构式为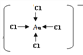 ;
;
(4)金、银、铜均为金属晶体,金属晶体中各原子层能相对滑动,且仍保持原来的排列方式,故都有良好的延展性;
(5)合金的晶胞为面心立方结构,银原子位于面心,金原子位于顶点,所以晶胞中银原子数为6×![]() =3,金原子数为8×
=3,金原子数为8×![]() =1,晶胞的体积为(anm)3,晶胞中金、银原子的总体积为
=1,晶胞的体积为(anm)3,晶胞中金、银原子的总体积为![]() (nm)3,则该晶胞的空间利用率(φ)为
(nm)3,则该晶胞的空间利用率(φ)为![]() ×100%。
×100%。



